Цинкового электрода.
Схематическая запись элемента:
Ag|AgCl, KCl| KCl | ZnSO4 (1 M)|Zn
Для приготовления этого элемента пользуются имеющимся цинковым электродом. Хлорсеребряный электрод Ag½AgCl,KClнасыщ является электродом сравнения, его потенциал eхс = 0,203 В. Этот электрод погружают в стаканчик с насыщенным раствором KCl, отсоединяют медный электрод и сохраняют его для 3-го и 4-го заданий. Присоединив зажимы к цинковому электроду и хлорсеребряному электроду, измеряют ЭДС хлорсеребряно-цинкового гальванического элемента и записывают в таблицу3 значение Еоп в вольтах.
Вычисляют потенциал цинкового электрода, используя уравнение:
Еоп = eхс - eZn, откуда eZn = eхс - Еоп
Проверив правильность полученных результатов у преподавателя, разбирают цинковый электрод. Вынимают из электродной ячейки цинковую пластинку, зачищают её и тщательно вытирают фильтровальной бумагой. Из ячейки выливают раствор ZnSO4 и ополаскивают её дистиллированной водой. Собрав полуэлемент, помещают его в стакан для хранения цинковых полуэлементов.
Задание 3. Измерение ЭДС медно-хлорсеребряного гальванического элемента и вычисление потенциала медного электрода.
Схематическая запись элемента:
Cu|CuSO4 (1 M)| KCl | KCl, AgCl|Ag
Для составления этого элемента используют медный электрод, приготовленный в первом разделе работы, и хлорсеребряный электрод сравнения, которым уже пользовались. Измеряют ЭДС так же, как в задании 2, и записывают результат в таблицу 3.
Затем вычисляют потенциал медного электрода, используя уравнение
Еоп = eCu - eхс, откуда eCu = Еоп + eхс.
Задание 4. Измерение ЭДС медного концентрационного
Гальванического элемента
Схематическая запись элемента:
Cu|CuSO4 (1 M)| KCl | CuSO4 (0,01 M)|Cu
Для составления медного концентрационного гальванического элемента используют уже приготовленный медный электрод и второй электрод с концентрацией CuSO4 0,01 M, приготовленный так: в проточную электродную ячейку наливают до половины её объема 0,01 М раствор CuSO4, опускают в раствор медную пластинку. Оба электрода опускают в стаканчик с насыщенным раствором KCl. Присоединив зажимы, измеряют Еоп. Проверяют результат у преподавателя, записывают его в таблицу 3. Разбирают медные электроды и ставят в соответствующие концентрациям стаканы для хранения.
Задания 5,6. Измерение ЭДС окислительно-восстановитель-ной цепи и вычисление окислительно-восстановительного потенциала.
Контрольные растворы для выполнения заданий 5 и 6 получают у преподавателя.
Задание 5.
Схематическая запись элемента:
Pt|  || KClнасыщ, AgCl|Ag
|| KClнасыщ, AgCl|Ag
Выливают из стаканчика насыщенный раствор KCl и ополаскивают его дистиллированной водой. В стаканчик наливают раствор, полученный у преподавателя, и опускают в него хлорсеребряный и ОВ- электроды. Подключив зажимы, измеряют ЭДС гальванического элемента и рассчитывают величину окислительно-восстановительного потенциала, используя уравнение:
Еоп = eов - eхс, откуда eов = Еоп + eхс.
Задание 6.
Схематическая запись элемента:
Pt| почва || KClнасыщ, AgCl|Ag
В стаканчик помещают образец почвы, добавляют дистиллированную воду (по заданию преподавателя) до получения однородной пастообразной массы. Опускают в образец хлорсеребряный и ОВ-электроды. Подключив зажимы, измеряют ЭДС гальванического элемента и рассчитывают величину окислительно-восстановительного потенциала почвы, используя уравнение:
Еоп = eов - eхс, откуда eов = Еоп + eхс.
Проверив правильность выполненной работы и отметив её у преподавателя, приводят в порядок рабочее место.
ДОМАШНЕЕ ЗАДАНИЕ
1. Вычислить теоретическую величину ЭДС гальванического элемента Даниеля-Якоби теоретически (Етеор):
Нормальный потенциал медного электрода e0Cu = 0,34 В.
Нормальный потенциал цинкового элетрода e0Zn = -0,76 В.
Поскольку fa,CuSO4 = fa,ZnSO4, теоретическая ЭДС элемента Даниеля-Якоби будет равна
Етеор = e0Cu - e0Zn
Вычисленную теоретическую величину ЭДС записывают в соответствующую графу табл. 3 и сравнивают её с ЭДС, найденной опытным путем. Эти величины должны отличаться не более, чем на 0,05 В.
2. Проверить правильность найденных значений электродных потенциалов медного и цинкового электродов, используя их опытные значения при вычислении ЭДС медно-цинкового гальванического элемента по уравнению
E = eCu - eZn
Сравнивают полученную величину с найденной величиной ЭДС опытным путем в первом задании. Если эти величины отличаются не более чем на 0,01 В, работа выполнена правильно.
3. Проверить правильность измерения ЭДС концентрационной цепи, вычислив теоретически ЭДС медного концентрационного элемента по уравнению
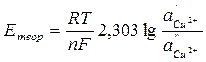
где – 2,303 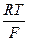 = 0,0577 + 0,0002(t –18) для любой температуры t, n – валентность ионов Cu2+; a’- активность ионов меди в 1 М растворе сульфата меди; f’- коэффициент активности ионов меди 1 М растворе сульфата меди, равный 0,041; a’’ – активность ионов меди в 0,01 М растворе сульфата меди; f’’ – коэффициент активности ионов меди в 0,01 М растворе сульфата меди, равный 0,41.
= 0,0577 + 0,0002(t –18) для любой температуры t, n – валентность ионов Cu2+; a’- активность ионов меди в 1 М растворе сульфата меди; f’- коэффициент активности ионов меди 1 М растворе сульфата меди, равный 0,041; a’’ – активность ионов меди в 0,01 М растворе сульфата меди; f’’ – коэффициент активности ионов меди в 0,01 М растворе сульфата меди, равный 0,41.
Вычисленную величину Етеор сравнивают с найденной опытным путем Еоп и, если они отличаются не более чем на 0,01 В, записывают результаты в таблицу 3.
4. Рассчитать активность окисленной формы Fе, если известна величина окислительно-восстановительного потенциала (из задания 5 или 6 по указанию преподавателя), активность восстановленной формы Fе равна 0,1, нормальный окислительно-восстановительный потенциал e0ов для данных окислителя и восстановителя равен 0,771 В.
Дата добавления: 2016-09-26; просмотров: 3773;











