Общие свойства ферментов
Количество фермента, присутствующего в тканях в любой данный момент времени, определяется относительными скоростями его синтеза и распада, а также концентрациями различного рода ингибиторов и активаторов. Как правило, распад ферментов и снижение их количества в среде происходят медленно. Ингибирование и активация ферментов могут осуществляться довольно быстро – в течение секунд.
Существует много методов для определения и выражения активности отдельных ферментов. Это обусловлено многообразием ферментов, наличием и использованием для определения их активности различных субстратов.
Международный биохимический союз предложил следующее определение единицы фермента: «За единицу любого фермента принимается то его количество, которое катализирует превращение одного микромоля субстрата в минуту при заданных стандартных условиях». Число микромолей и будет равно числу стандартных единиц. Международная комиссия предложила, если это возможно, проводить определение активности ферментов при 30 °С и при оптимальных для ферментативной активности значениях рН и концентрации субстрата.
Общие свойства ферментов вытекают из ихбелковой природы. Ферменты термолабильны, их активность зависит от рН среды и влажности, в которой они действуют, а также от влияния активаторов и ингибиторов.
При повышении температуры до определенных пределов активность ферментов усиливается. При достижении оптимальной для фермента температуры его каталитическая активность бывает наиболее высокой. Оптимальная температура для многих ферментов лежит чаще всего в пределах от 40 до 50 °С (оптимальная для растительных ферментов – 50 – 60 °С, а для ферментов животного происхождения – 40 – 50 °С). Однако оптимальная температура не является строго постоянной и зависит от многих причин, и в частности от продолжительности нагревания. Чем продолжительнее действие фермента, тем оптимальная температура должна быть ниже.
В интервале температур от 0 до 50 °С при повышении или понижении температуры на каждые 10 °С активность ферментов возрастает или соответственно падает в 1,4 – 2 раза. При дальнейшем нагревании активность ферментов снижается, и при 80 – 100 °С ферменты обычно полностью теряют каталитические свойства в связи с денатурацией белка.
Температура инактивации (потери активности) у разных ферментов неодинакова. Так, инактивация фермента амилазы в растворе происходит при 70 °С, сахаразы – при 59, трипсина и пепсина – при 65 °С. В сухом состоянии ферменты могут переносить нагревание до более высоких температур. Но при очень высоких температурах инактивация ферментов наступает мгновенно. При пастеризации, стерилизации, бланшировке и кипячении ферменты разрушаются.
После тепловой инактивации некоторые ферменты восстанавливают свою каталитическую активность. Примером может служить пероксидаза, которая даже при нагревании в течение 60 с до 150 °С не полностью теряет каталитические свойства. Поэтому пероксидазу считают самым термостабильным ферментом.
При температурах ниже 0 °С каталитическая деятельность ферментов резко снижается, но все же сохраняется даже при замораживании продуктов.
Реакция среды оказывает существенное влияние на каталитическую активность ферментов. Ферменты изменяют свою растворимость, осмотическое давление, вязкость и другие свойства под влиянием рН среды. Полагают, что изменение ферментативной активности в зависимости от рН среды связано с изменением ионизации ферментов, субстрата или фермент-субстратного комплекса.
Ферменты проявляют оптимальную активность только в определенных, свойственных им пределах рН. Так, пепсин, который выделяется в сильнокислую среду желудка, имеет оптимум активности при рН 1,5 и 2,5. В то же время протеазы, которые выделяются поджелудочной железой в двенадцатиперстную кишку, имеют оптимальную активность в щелочной зоне рН, а оптимум действия трипсина лежит в пределах рН 8 – 9. При значении рН выше или ниже оптимальной активность ферментов снижается.
Большинство ферментов бывают наиболее активными в нейтральных, слабощелочных или слабокислых средах. По мере сдвига значения рН от оптимальной в кислую или щелочную среду активность ферментов падает.
Активаторы и ингибиторы (парализаторы) ферментов могут соответственно усиливать или ослаблять и даже прекращать их деятельность. Активаторами ферментов являются ионы металлов: Na+, K+, Rb+, Mg2+, Ca2+, Cu2+, Fe2+ и соединения, содержащие сульфгидрильные группы: SH, HCN, H2S. Наличие в растворе указанных металлов или соединений в определенной концентрации способствует проявлению полной активности некоторых ферментов.
Все ферменты подвержены ингибированию в результате денатурации или разрушения ферментного белка.
Сущность действия ингибиторов в большинстве случаев состоит в том, что они соединяются с активными группами или активными центрами молекулы ферментов. Различают ингибиторы общего и специфического характера. К общим ингибиторам, которые подавляют действие всех ферментов, относят соли тяжелых металлов (свинца, серебра, ртути), трихлоруксусную кислоту и танин. Часто торможение или прекращение действия ферментов под влиянием тяжелых металлов носит обратимый характер, и если в среду добавить вещества, образующие соединения с этими металлами, то активность ферментов восстанавливается.
Специфические ингибиторы действуют только на определенные ферменты. Так, синильная кислота действует только на окислительные ферменты, содержащие в активном центре железо или медь. Синильная кислота вступает в соединение с металлами, и фермент теряет активность.
В живой клетке регулирование действия ферментов осуществляется не только с помощью специфических активаторов и ингибиторов, но также путем связывания ферментов на различных коллоидных структурах протоплазмы. Такое связывание ферментов приводит к потере ими активности. Освобождение фермента из соединения вновь восстанавливает его каталитическую активность.
Ферменты инактивируются при очень высоких давлениях. Однако после снятия давления ферменты восстанавливают свою каталитическую активность.
Действие ферментов сильно замедляется в сухих продуктах, однако полностью не прекращается. Результаты активности ферментов могут проявляться в изменении качества продукта – его потемнении, ухудшении аромата, вкуса, консистенции и т. д.
Скорость большей части ферментальных реакций пропорциональна концентрации фермента, по крайней мере, на самых ранних стадиях. За пределами начальных стадий скорость ферментативных реакций падает.
Фермент образует с субстратом комплекс, который диссоциирует на свободный фермент и конечный продукт реакции:
Е + S ↔ ЕS;
ЕS↔ Е + Р,
где Е – фермент; S – субстрат; ЕS – ферментно-субстратный комплекс; Р – конечный продукт.
Количество субстрата очень велико по сравнению с количеством фермента, и поэтому концентрация субстрата сильно влияет на скорость ферментативных реакций. Если субстрат содержится в значительном избытке, то количество образующегося продукта пропорционально времени. По мере уменьшения концентрации субстрата количество образующегося в единицу времени конечного продукта (Р) снижается.
О наличии в растворе фермента судят по его действию. Так, о наличии амилазы в слюне можно судить по способности слюны осахаривать крахмал, о наличии желудочного пепсина – по его способности растворять с достаточной быстротой яичный белок или фибрин.
Регулируя активность ферментов созданием соответствующей реакции среды, можно управлять скоростью катализируемых ими реакций, а также деятельностью ферментов, содержащихся в пищевых продуктах, что позволяет осуществлять мероприятия по хранению зерна, картофеля, плодов и овощей, производству ряда продуктов (вина, чая и т. д.).
Номенклатура и классификация ферментов
В начальный период развития учения о ферментах им давали названия без определенной системы, по случайным признакам, по названию субстрата или типу катализируемой реакции. Так, фермент пепсин получил название от греческого слова «пепсис» – перевариваю, папаин – от сока растения папайи, богатого ферментом. Случалось, что отдельные авторы одному и тому же ферменту давали разные названия.
В связи с бурным развитием науки о ферментах – ферментологии в 1961 г. постоянным комитетом по ферментам при Международном биохимическом союзе была разработана современная номенклатура и классификация ферментов. В соответствии с этой классификацией название фермента составлялось из химического названия субстрата и названия той реакции, которая осуществлялась ферментом. К латинскому названию корня субстрата, на который действует фермент (сахароза – сахараза), или к названию процесса, катализируемого данным ферментом (гидролиз – гидролазы), добавлялось окончание «аза». Наряду с новыми названиями для многих ферментов сохранились старые, прочно вошедшие в научную литературу (пепсин, трипсин, папаин и др.).
По современной классификации все ферменты делят на шесть классов: оксидоредуктазы; трансферазы; гидролазы; лиазы; изомеразы; лигазы (синтетазы). Классификация ферментов основана на характере их действия.
Каждый класс подразделяют на подклассы, а каждый подкласс – на группы.
Оксидоредуктазы
Это ферменты, катализирующие окислительно-восстановительные реакции, которые происходят в живых организмах. Реакции окисления веществ в организмах всегда сопровождаются реакциями восстановления. Оксидоредуктазы делят на 14 подклассов (наиболее обширный класс ферментов).
Окисление протекает как процесс отнятия водорода (электронов) от субстрата, а восстановление – как присоединение атомов водорода (электронов) к акцептору. Эту реакцию схематично можно представить в следующем виде:
АН2 + В = А + ВН2,
где АН2 – вещество, отдающее свой водород и называемое донатором; В – вещество, отнимающее водород и называемое акцептором.
Окислению могут подвергаться разнообразные вещества – углеводы, жиры, белки, аминокислоты, витамины и др.
Роль оксидоредуктаз в живых тканях выполняют обширные группы дегидрогеназ и оксидаз, которые носят название в зависимости от окисляемого ими субстрата. Так, фермент, дегидрирующий яблочную кислоту, называется малатдегидрогеназой, дегидрирующий этиловый спирт – алкогольдегидрогеназой и т. д.
В классе оксидоредуктаз основное значение имеют дегидрогеназы, которые осуществляют реакцию дегидрирования. Все дегидрогеназы делят на две группы: анаэробные и аэробные, которые называют оксидазами.
Анаэробные дегидрогеназы представляют собой специфические ферменты, катализирующие отщепление водорода от определенных химических веществ и передающие его другим ферментам – переносчикам водорода. Эти дегидрогеназы являются двухкомпонентными ферментами, в которых кофермент легко отделяется от белковой части. В качестве кофермента в состав анаэробных дегидрогеназ могут входить два вещества – никотин-амид-аденин-нуклеотид (НАД) или никотин-амид-аделинин-нуклеотид-фосфат (НАДФ). Оба эти вещества обладают исключительно высокой реакционной окислительно-восстановительной способностью.
Известно очень много анаэробных дегидрогеназ, катализирующих окисление различных органических соединений. Так, лактатдегидрогеназа катализирует реакцию окисления молочной кислоты до пировиноградной, изоцитратдегидрогеназа – окисление изолимонной кислоты до щавелево-янтарной.
К группеаэробных дегидрогеназ (оксидаз) относят ферменты, в состав которых в качестве кофермента входит витамин В2, (рибофлавин), поэтому такие ферменты называют флавиновыми. Флавиновые ферменты способны отнимать водород от окисляемого вещества и передавать его другим соединениям или кислороду воздуха:
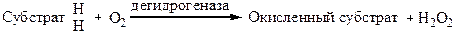 ,
,
2Н2О2 → 2Н2О + О2.
Отнимая водород от окисляемого вещества и передавая его кислороду воздуха, оксидаза может при этом образовывать воду или перекись водорода (Н2О или Н2О2). К этой группе ферментов относятся полифенолоксидаза, аскорбинатоксидаза, глюкооксидаза.
Полифенолоксидаза представляет собой аэробную дегидрогеназу, для которой акцептором водорода является газообразный кислород.
Она действует на о-дифенолы, полифенолы, дубильные вещества и тирозин. Полифенолоксидаза широко распространена в грибах и высших растениях, особенно ее много в зеленом чайном листе. Действием полифенолоксидазы объясняется потемнение на разрезе мякоти плодов и овощей, картофеля, а также потемнение свежего чайного листа при его скручивании. Полифенолоксидаза играет большую роль в качестве промежуточного звена при дыхании растений.
Фермент пероксидаза наряду с полифенолоксидазой и цитохромоксидазой активно участвует в процессах дыхания растений и защитных реакциях растений против фитопатогенных микроорганизмов растений.
Активная группа пероксидазы содержит железо. С помощью фермента пероксидазы за счет перекиси водорода и некоторых других органических перекисей происходит окисление органических соединений. Пероксидаза образует комплексное органическое соединение, вследствие чего перекись активируется и приобретает способность действовать как акцептор водорода:
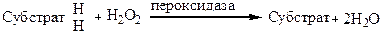 .
.
Многие органические соединения реагируют с кислородом воздуха и образуют перекиси. Особенно легко образуются перекиси при окислении кислородом воздуха соединений, имеющих непредельные связи: каротиноидов, ненасыщенных жирных кислот, некоторых углеводородов.
Фермент каталаза катализирует процесс расщепления перекиси водорода на воду и кислород:
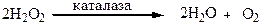 .
.
В состав молекулы каталазы, как и пероксидазы, входит железо. Главное назначение каталазы в организме состоит в том, что она разрушает вредную для клеток перекись водорода, образующуюся в процессе дыхания.
Фермент липоксигеназа катализирует образование перекисей и гидроперекисей при окислительной порче жиров.
| <== предыдущая лекция | | | следующая лекция ==> |
| Подробнее о ферментах. | | | Лигазы, или синтетазы |
Дата добавления: 2016-09-26; просмотров: 5340;











