Получение оксидов из уранилнитрата
Технологическая схема получения триоксида урана из растворов уранилнитрата, приведенная на рис. 1.2.2, состоит из двух основных операций:
а) выпаривание растворов уранилнитрата до концентрации, соответствующей составу UО2(NO3)2·6Н2О;
б) дальнейшее прокаливание гексагидрата уранилнитрата, при котором происходит дополнительная дегидратация и денитрация с образованием триоксида:
UО2(NO3)2·nН2О → UО3 + NО +NО2 +О2 + nН2О. (1.2.1)
Шестиводный и трехводный гидраты уранилнитрата плавятся инкон-груэнтно соответственно при 60 и 113 °C. Система уранилнитрат – вода стабильна до точки плавления дигидрата 184 °C. Выше 184 °C происходит разложение на триоксид урана и оксиды азота. Первое превращение гексагидрата уранилнитрата при термическом разложении идет до тригидрата по реакции:
UО2(NO3)2·6Н2О → UО2(NO3)2·3Н2О + 3Н2О. (1.2.2)
Равновесное давление водяных паров (P, мм. рт. ст) этой реакции выражается уравнением:
lgP = – 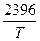 + 9,010. (1.2.3)
+ 9,010. (1.2.3)
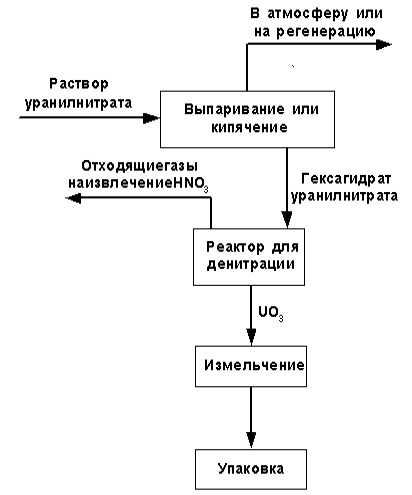 Рис. 1.2.2 Технологическая схема производства триоксида урана из уранилнитрата
Рис. 1.2.2 Технологическая схема производства триоксида урана из уранилнитрата
|
Теплота дегидратации равна 45,67 кДж/молъ воды.
Превращение тригидрата в дигидрат протекает по реакции:
UО2(NO3)2·3Н2О → UО2(NO3)2·2Н2О + Н2O. (1.2.4)
Равновесное давление паров воды (P, мм. рт. ст) от температуры (T, К) выражается уравнением:
lgP = –  + 10,926. (1.2.5)
+ 10,926. (1.2.5)
Теплота дегидратации равна 62,85 кДж/моль. Давление разложения над UО2(NO3)2·2Н2О при 126,3 °С равно 20 мм рт. ст. В газах – продуктах разложения – присутствует некоторое количество N2О4. Окончательно процесс разложения протекает по следующим реакциям:
UО2(NO3)2·2Н2О → UО2(NO3)2 + 2Н2O, (1.2.6)
UО2(NO3)2 → UО3 + N2О4 + 0,5 О2. (1.2.7)
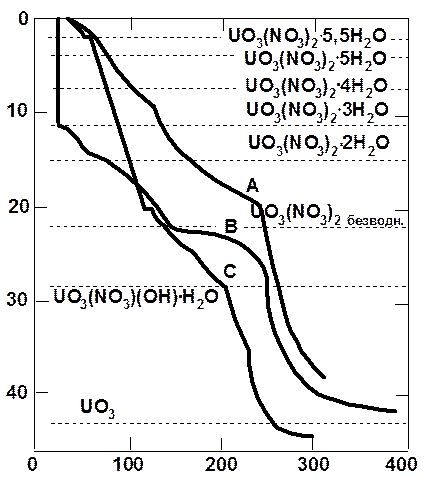 А – разложение на воздухе, скорость нагревания 2°/мин; В – то же в вакууме; С – на воздухе, скорость нагревания 1°/мин.
Рис. 1.2.3 Термогравиметрические кривые разложения гексагидрата уранилнитрата
А – разложение на воздухе, скорость нагревания 2°/мин; В – то же в вакууме; С – на воздухе, скорость нагревания 1°/мин.
Рис. 1.2.3 Термогравиметрические кривые разложения гексагидрата уранилнитрата
|
Ход разложения уранилнитрата при непрерывном повышении температуры зависит от того, проводится ли оно на воздухе или в вакууме. На рис. 1.2.3 показаны термогравиметрические кривые разложения гексагидрата уранилнитрата. Денитрация в вакууме протекает быстрее, чем при атмосферном давлении. Скорость нагрева также влияет на форму термогравиметрической кривой. При меньших скоростях нагрева уранилнитрат разлагается при более низкой температуре. Несмотря на различие процессов разложения при низких температурах на воздухе и в вакууме, температура диссоциации UО2(NO3)2 во всех случаях почти одинакова. Оптимальной температурой разложения уранилнитрата до триоксида составляет 400 °С, так как выше 430 °С триоксид урана начинает отщеплять кислород. Кроме того, при низкой температуре получается более реакционноспособный триоксид урана, легко превращаемый в диокиид и тетрафторид; поэтому процесс термической диссоциации уранилнитрата проводят при температурах, не превышающих 400-450 °С.
Полученный в промышленных условиях триоксид урана обычно содержит 0,04-0,1 % азота, концентрацию которого в результате повторной гидратации и дегидратации снижают до 0,001 %.
UО3 + 2Н2O  UО3·2Н2O, (1.2.8)
UО3·2Н2O, (1.2.8)
UО3 + 0,8Н2O 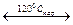 UО3·0,8Н2O. (1.2.9)
UО3·0,8Н2O. (1.2.9)
Обе обратные реакции протекают при 400 °С.
Физические свойства триоксида урана зависят от температуры прокаливания и скорости подъема температуры. При медленном нагревании гексагидрата уранилнитрата до 350-400 °С образуется триоксид урана, имеющий насыпной вес 2800 кг/м3, при быстром – 4200 кг/м3. Первый из образцов обладает значительно большей реакционной способностью, чем второй (если термическую диссоциацию уранилнитрата проводить в токе аммиака, то насыпная масса оксидов урана уменьшается до 1,5-1,8 г/см3. Размер кристаллов триоксида урана колеблется в пределах около 1 мкм.Разлагают уранилнитрат в аппаратах периодического и непрерывного действия (печах кипящего слоя).
Дата добавления: 2019-05-21; просмотров: 765;











