Модель атома Томсона и Резерфорда
Теория атома водорода по Бору
Представление об атомах как неделимых мельчайших частицах вещества возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века учение об атомах, будучи материалистическим, не смогло получить признания, а тем более, дальнейшего развития. К началу XVIII века атомистическая теория приобретает все большую популярность, так как к этому времени в работах А. Лавуазье, М.В. Ломоносова и Д. Дальтона была доказана реальность существования атомов. Однако, в это время вопрос о внутреннем строении атомов даже не возникал, так как атомы по-прежнему считались неделимыми.
Большую роль в развитии атомистической теории сыграл Д.И. Менделеев, разработавший в 1869 г. Периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX века экспериментально было доказано, что электрон является одной из основных составных частей любого вещества. Эти выводы, а также многочисленные экспериментальные данные привели к тому, что в начале XX века серьезно встал вопрос о строении атома.
Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Дж. Томсону. Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10-10 м, внутри которого около своих положений равновесия колеблются электроны, суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно.
В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда по рассеянию a-частиц в веществе. Альфа-частицы возникают при радиоактивных превращениях, они являются положительно заряженными частицами с зарядом 2e и массой, примерно в 7300 раз большей массы электрона. Пучки a-частиц обладают высокой монохроматичностью, то есть имеют практически одну и ту же скорость порядка 107 м/с.
Э. Резерфорд, исследуя прохождение a-частиц в веществе (через золотую фольгу толщиной примерно 1 мкм), показал, что основная их часть испытывает незначительные отклонения, но некоторые a-частицы (примерно одна из 20 000) резко отклоняются от первоначального направления (углы отклонения достигали даже 180°). Так как электроны не могут существенно изменить движение столь тяжелых и быстрых частиц, как a-частицы, то Резерфордом был сделан вывод, что значительное отклонение a-частиц обусловлено их взаимодействием с положительным зарядом большой массы. Однако значительное отклонение испытывают лишь немногие a-частицы, следовательно, лишь некоторые из них проходят вблизи данного положительного заряда. Это, в свою очередь, означает, что положительный заряд атома сосредоточен в объеме, очень малом по сравнению с объемом атома.
На основании своих опытов Резерфорд в 1911 году предложил ядерную (планетарную) модель атома.Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze (Z – порядковый номер элемента в периодической системе химических элементов, e = 1,6×10-19 Кл – элементарный заряд), размер 10-15 – 10-14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10-10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, то есть вокруг ядра должно вращаться Z электронов.
Исходя из предположений, что взаимодействие указанных a-частиц с ядром является кулоновским, а заряд и масса ядра локализованы в очень малой области атома, Резерфорд разработал также и количественную теорию рассеяния a-частиц и вывел формулу для распределения рассеянных a-частиц в зависимости от угла отклонения q. В своих рассуждениях Резерфорд принимал во внимание рассеяние a-частиц только на ядрах, поскольку заметного отклонения a-частиц электронами не может быть из-за того, что масса электронов на четыре порядка меньше массы a-частиц.
Кулоновская сила взаимодействия между ядром и электроном сообщает электрону центростремительное ускорение. Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид:
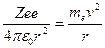 , (1.1)
, (1.1)
где me и v – масса и скорость электрона на орбите радиуса r, e0 – электрическая постоянная.
Уравнение (1.1) содержит два неизвестных: r и v. Следовательно, существует бесчисленное множество значений радиуса и соответствующих ему значений скорости (в, значит, и энергии), удовлетворяющих этому уравнению. Поэтому величины r и v, а также энергии E, могут меняться непрерывно, т.е. может испускаться любая, а не вполне определенная порция энергии. Тогда спектры атомов должны быть сплошными. В действительности же опыт показывает, что атомы имеют линейчатый спектр. Из выражения (1.1) следует, что при r ~ 10-10 м скорость движения электронов v » 106 м/с, а ускорение v2/ r = 1022 м/с2. Согласно классической электродинамике, ускоренно движущиеся электроны должны излучать электромагнитные волны и вследствие этого непрерывно терять энергию. В результате электроны будут приближаться к ядру и упадут на него. Таким образом, атом Резерфорда оказывается неустойчивой системой, что противоречит действительности.
Попытки построить модель атома в рамках классической физики не привели к успеху: модель Томсона была опровергнута опытами Резерфорда, ядерная же модель оказалась неустойчивой и противоречила опытным данным. Преодоление возникших трудностей потребовало создания качественно новой – квантовой – теории атома.
Дата добавления: 2020-12-11; просмотров: 436;











