Линейчатый спектр атома водорода.
Исследования спектров излучения разреженных газов (т. е. спектров излучения отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома – атома водорода.
Швейцарский ученый И. Бальмер подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
 (1.2)
(1.2)
где R’ = 1,10×107 м-1 – постоянная Ридберга. Так как n=с/l, то формула (1.2) может быть переписана для частот:
 (1.3)
(1.3)
где R =R’c=3,29×1015 c-1 – также постоянная Ридберга.
Из выражений (1.2) и (1.3) следует, что спектральные линии, отличающиеся различными значениями n, образуют группу или серию линий, называемую серию Бальмера. С увеличением n линии серии сближаются. Значение n = ¥ определяет границу серии, к которой со стороны больших частот примыкает сплошной спектр.
В дальнейшем в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана.

В инфракрасной области спектра были также обнаружены:
 серия Пашена;
серия Пашена;
 серия Брэкета;
серия Брэкета;
 серия Пфунда;
серия Пфунда;
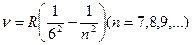 серия Хэмфри.
серия Хэмфри.
Все приведенные выше серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера:
 (1.4).
(1.4).
Исследование более сложных спектров – спектров паров щелочных металлов – показало, что они представляются набором незакономерно расположенных линий. Ридбергу удалось разделить их на три серии, каждая из которых располагается подобно бальмеровской серии.
Приведенные выше сериальные формулы подобраны эмпирически и долгое время не имели теоретического обоснования, хотя и были подтверждены экспериментально с очень большой точностью. Приведенный выше вид сериальных формул, повторяемость в них целых чисел, универсальность постоянной Ридберга свидетельствуют о глубоком физическом смысле найденных закономерностей, вскрыть который в рамках классической физики оказалось невозможным.
Постулаты Бора.
Первая попытка построить качественно новую – квантовую – теорию атома была предпринята в 1913 г. датским физиком Нильсом Бором. Он поставил перед собой цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил два постулата.
Первый постулат Бора (постулат стационарных состояний):в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергию. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
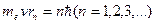 (1.5),
(1.5),
Второй постулат Бора (правило частот):при переходе электрона с одной стационарной орбиты на другую излучается (или поглощается) один фотон с энергией
 (1.6)
(1.6)
Равной разности энергий соответствующих стационарных состояний. Если разность  , происходит излучение фотона, т.е. переход атома из состояния с большей энергией в состояние с меньшей энергией. Если
, происходит излучение фотона, т.е. переход атома из состояния с большей энергией в состояние с меньшей энергией. Если  , происходит поглощение (переход атома в состояние с большей энергией). Из формулы (1.6) следует набор возможных частот квантовых переходов и определяет линейчатый спектр атома.
, происходит поглощение (переход атома в состояние с большей энергией). Из формулы (1.6) следует набор возможных частот квантовых переходов и определяет линейчатый спектр атома.
Дата добавления: 2020-12-11; просмотров: 425;











