Ионообменная адсорбция
Ионообменная адсорбция – это процесс, при котором твердый адсорбент обменивает свои ионы на ионы того же знака из раствора в эквивалентных количествах.
Первые сообщения об ионообменной адсорбции были сделаны в 1850 году независимо друг от друга английскими учеными Томпсоном и Уэем. Изучая способность почв к поглощению удобрений и их вымыванию дождем, они обнаружили обмен ионами между почвой и водными растворами солей.
К особенностям ионного обмена относятся: а) высокая специфичность, т.е. к обмену способны только определенные ионы; б) меньшая скорость, чем у молекулярной адсорбции; в) возможность изменения рН среды; г) процесс не всегда обратим.
Адсорбенты, на которых протекает ионообменная адсорбция, называются ионитами или ионообменниками. Они бывают как природного происхождения (почвы, цеолиты), так и синтетически полученные. Иониты могут иметь кислотный, основной или амфотерный характер. Вещества кислотного характера обмениваются с раствором катионами и называются катионитами. Основные сорбенты - аниониты- отдают в раствор анионы, замещая их анионами раствора. Амфотерные иониты содержат и катионные, и анионные обмениваемые группы, т.е. они могут одновременно сорбировать и катионы, и анионы.
К природным неорганическим катионитам относятся кристаллические силикаты (шабазит, глауконит и др.), анионитам – некоторые минералы, например, апатит. Природными ионитами органического происхождения являются, например, содержащиеся в почве гуминовые кислоты – высокомолекулярные соединения, обладающие амфотерными свойствами. Природные иониты не нашли широкого практического применения, т.к. имеют ряд недостатков, в частности, они химически нестойки и не обладают достаточной механической прочностью.
В 1935 году Б. Адамс и Е. Холмс получили ионообменные материалы на основе искусственных полимерных соединений. В настоящее время широко используются
иониты на основе органических смол – синтетические ионообменные смолы. Неорганические иониты имеют кристаллическую структуру, способные к обмену ионы содержатся в их решетках. Органические полимерные ионообменники имеют пространственную структуру, на которой расположены ионогенные группы, определяющие свойства ионитов (Рис. 13). В катионитах такими группами могут быть - СООН, - SО3Н, - ОН, - SiOН, обменивающие ион Н+ на катионы раствора.
R-SO3-H+ + Na+Cl-  R-SO3-Na+ + H+Cl-
R-SO3-Na+ + H+Cl-
где R -органическая полимерная матрица. В анионитах содержатся активные группы: -NH2,  NH,
NH,  N, -N(CH3)3Cl. Анионообменники применяют как в ОН- форме, так и в хлоридной, карбонатной и других.
N, -N(CH3)3Cl. Анионообменники применяют как в ОН- форме, так и в хлоридной, карбонатной и других.
ROH- + Na+Cl-  RCl- + Na+OH-
RCl- + Na+OH-
Основными достоинствами синтетических ионообменников являются химическая стойкость, механическая прочность, разнообразие кислотно-основных свойств, большая обменная емкость. Обменную емкость выражают в молях или миллимолях извлекаемых из раствора ионов в расчете на единицу массы сухого ионита. После проведения сорбции иониты можно регенерировать, обрабатывая катиониты кислотой, аниониты - щелочью.
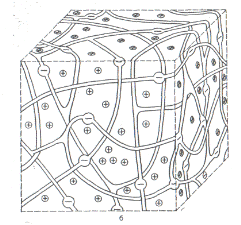
Рис. 13
Значение ионного обмена чрезвычайно велико. Так, пропуская засоленную воду через катионит, а затем через анионит, можно провести её деминерализацию (обессоливание). Аналогично протекает процесс умягчения воды. С помощью ионитов производят очистку сахарных концентратов, извлечение ценных металлов из отходов производств (Au, Ag, Cu, Cr и др.), выделение и очистку витаминов, антибиотиков, разделение смесей аминокислот, радиоактивных веществ, редкоземельных элементов. Перспективным является применение ионитов для целей анализа и при изготовлении чистых реактивов. В стадии изучения находится вопрос о медицинском использовании ионитов путем введения их высокодисперсных форм непосредственно в ЖКТ для связывания ядовитых веществ, токсинов, а также для нормализации ионного баланса в организме.
ЗАКЛЮЧЕНИЕ
Адсорбция из растворов – процесс более сложный по сравнению с адсорбцией на границе «жидкость-газ», поскольку в борьбу за активные центры адсорбента вступают молекулы растворителя и молекулы или ионы растворенного вещества.
Молекулярная адсорбция (адсорбция неэлектролитов) существенно зависит от свойств растворенного вещества, растворителя и адсорбента. Так, а) вещество адсорбируется тем лучше, чем оно менее растворимо в данном растворителе; б) на твердых поверхностях адсорбируются только те вещества, которые обладают полярностью, промежуточной между полярностями фаз; в) неполярные твердые тела лучше адсорбируют неполярные адсорбаты и наоборот. С ростом температуры величина молекулярной адсорбции уменьшается, что указывает на её физический характер.
Из растворов сильных электролитов на поверхности твердых веществ адсорбируются ионы. Величина адсорбции увеличивается с ростом температуры, увеличением кристаллического радиуса иона и его заряда, противоположного заряду поверхности. На поверхности кристаллов избирательно адсорбируются ионы, способные достраивать кристаллическую решетку.
На границе твердое тело-раствор может наблюдаться ионный обмен, к которому склонные некоторые твердые вещества – иониты. Они обменивают свои ионы на ионы того же знака в растворе в эквивалентных количествах.
ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ
1. Как рассчитывается количество молекулярно адсорбированного вещества?
2. Метод нахождения констант в уравнении Фрейндлиха.
3. По каким механизмам может протекать ионная адсорбция?
4. В чем сущность ионообменной адсорбции?
5. Частицы Fe(OH)3 находятся в растворе, где присутствуют ионы FeO+, Cl-,H+. Какие ионы будут адсорбироваться на поверхности Fe(OH)3?
6. Какой тип ионообменника следует взять для устранения жесткости воды?
Дата добавления: 2016-08-23; просмотров: 11168;











