Конечный этап свертывания плазмы - образование фибринового сгустка
Конечная стадия каскада свертывания плазмы заключается в образовании из растворимого плазменного белка фибриногена нерастворимого фибрина под воздействием тромбина и ф.ХIII (рис. 42).
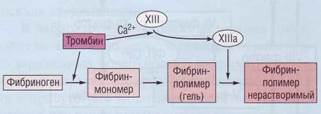
Рис. 42. Последовательные стадии образования нерастворимого фибринаиз растворимого фибриногена
Тромбин
Тромбин - ключевой фермент гемостаза. Тромбин - витамин-К-зависимый белок - является сериновой протеазой. В печени происходит синтез неактивного предшественника протромбина, который в дальнейшем циркулирует в плазме. В комплексе ф.Ха-Va-II на фосфолипидной поверхности происходит ограниченный протео-лиз протромбина. Образуется несколько активных структур с уменьшающейся молекулярной массой - мезотромбин, α-тромбин,β-тромбин, γ-тромбин. Наиболее значимым продуктом является сериновая протеаза - α-тромбин. На мо-
лекуле тромбина имеется, по крайней мере, 4 сайта связывания для субстратов, ингибиторов, кофакторов и иона кальция. Это, а также способность тромбина активно функционировать не только на твердой фазе, но и в токе крови позволяет ему выполнять многочисленные функции. Важнейшие функции тромбина в гемостазе:
• Ограниченный протеолиз фибриногена до
фибрин-мономеров (происходит в жидкой
фазе - кровотоке).
• Активация ф.V, -VIII, -VII, -XI.
• Активация тромбоцитов.
• В комплексе с тромбомодулином тромбин
активирует протеин С.
• Активация ф.ХIII.
• Ограниченный протеолиз плазматической
карбоксипептидазы В до активной формы -
активируемого тромбином ингибитора фиб
ринолиза (TAFI).
• Стимуляция выброса из эндотелиоцитов тка
невого активатора плазминогена.
Однако роль тромбина в организме не огра
ничивается вышеперечисленными функциями.
Ключевая роль в процессе свертывания крови,
активация сосудистого эндотелия, клеточный
рост и процессы репарации, активация перифе
рических клеток крови, активация фибриноли
за - это наиболее изученные функции тромби
на. Видимо, со временем этот список значитель
но увеличится.
Плазменные белки гемостаза
Косвенным подтверждением важности тромбина для организма может служить тот факт, что известны лишь единичные описания пациентов с гомозиготным дефектом молекулы тромбина, а пациенты с гипопротромбинемией встречаются чрезвычайно редко.
Важнейшим ингибитором тромбина является антитромбин III. Несколько меньшую роль играет кофактор гепарина П.
Фактор XIII
Фактор XIII - трансглютаминаза. В плазме большая часть неактивного ф.ХIII связана с фибриногеном. Активация ф.ХIII происходит путем ограниченного протеолиза неактивного ф.ХIII тромбином одновременно с отщеплением пептида А от фибриногена. Как и большинство других ферментов, он выполняет несколько функций в гемостазе:
• Стабилизирует фибриновый сгусток путем
образования ковалентных связей между у-це-
пями мономеров фибрина.
• Участвует в связывании, α-ингибитора плаз-
мина с фибрином, что способствует предотв
ращению преждевременного лизиса фибрино-
вого сгустка.
• Значительную роль ф.ХIII играет в процес
сах полимеризации актина, миозина и других
компонентов цитоскелета тромбоцитов, что
чрезвычайно важно для активации тромбо
цитов и ретракции образовавшегося фибри-
нового сгустка. Это объясняет наличие ф.ХIII
в цитоплазме тромбоцитов.
• Обнаружены перекрестные реакции ф.ХIII с
ф.V, фон Виллебранд протеином.
Помимо непосредственно реакций гемостаза,
ф.ХIII участвует в процессах образования соединительной ткани, репаративных реакциях:
• Участвует в связывании молекул фибронек-
тина между собой и с молекулами фибрина.
Вероятно, это важно для направленной миг
рации клеток и процессов репарации.
• Играет роль в биосинтезе коллагена, катали
зируя образование связей между молекулами
коллагена типов I, II, III и V.
крови и образовывать прочную объемную структуру, которая эффективно закрывает повреждение сосуда и предотвращает потерю крови. Концентрация фибриногена в крови здорового человека значительно выше, чем концентрация других белков гемостаза, что связано с его уникальной ролью.
Синтез фибриногена происходит в печени и не зависит от витамина К. Некоторое количество фибриногена синтезируется в мегакариоцитах и содержится в тромбоцитах. Этот фибриноген несколько отличается от фибриногена, синтезированного в печени.
Помимо гепатоцитов и мегакариоцитов, активность гена γ-цепей фибриногена обнаружена в некоторых других тканях - головном мозге, легких, костном мозге, где γ-цепи фибриногена, видимо, выступают в роли молекул адгезии.
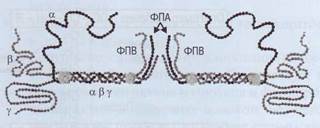
Фибриноген - большой многокомпонентный белок, который состоит из трех пар полипептидных цепей - 2α, 2β, 2γ, связанных между собой дисульфидными мостиками и переплетенных друг относительно друга (рис. 43).
Пространственная структура молекулы фибриногена состоит из центрального Е-доме-на и 2 периферических D-доменов. α- и β-цепи формируют глобулярные структуры - фибрино-пептиды А и В (ФПА и ФПВ), которые закрывают комплементарные участки в фибриногене и не позволяют этой молекуле полимеризовать-ся. Процесс взаимодействия фибриногена и тромбина происходит в жидкой фазе - кровотоке. Тромбин соединяется с фибриногеном и отщепляет конечные последовательности от α- и β-це-пей - 2 ФПА и 2 ФПВ (рис. 44). Образуются ра-
Фибриноген.
Формирование гемостатического тромба
Фибриноген - уникальная молекула, обладающая свойством быстро полимеризоваться в токе
Рис. 43. Фибриногенсостоит из 3 парных белковых молекул α, β и γ, Фибринопептиды А и В (ФПА и ФПВ) отщепляются тромбином от фибриногена, инициируя тем самым процесс полимеризации и превращение фибриногена в фибрин
Плазменные белки гемостаза
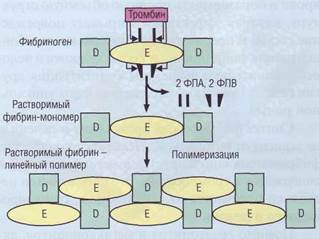
Рис. 44. Формирование фибрин-мономеровиз фибриногена. Тромбин отщепляет фибринопептиды ФПА и ФПВ от молекулы фибриногена, тем самым образуются растворимые мономеры фибрина, которые способны полимери-зоваться до линейного полимера, или «растворимого фибрина»
створимые мономеры фибрина. В дальнейшем происходит спонтанное соединение комплиментарных участков фибрин-мономеров. Сначала образуются димеры, далее олигомеры и в конечном итоге собираются мононити полимери-зованного фибрина. Таким образом, фибрино-вая цепь формируется спонтанной, конец в конец полимеризацией фибрин-мономеров, при которой концевая часть одного мономера взаимодействует с центральной частью другого мономера в месте отщепления ФПА. Результатом такой полимеризации является линейный полимер шириной в 2 молекулы (рис. 44). На этом этапе фибрин легко растворим в 5-молярной
мочевине, поэтому он получил название растворимого фибрина.
Соединяясь с фибриногеном, тромбин не только отщепляет фибринопептиды. но и активирует связанный с ним фактор XIII. Фактор ХIIIа образует ковалентные связи между γ-цепями (D-доме-нами) нитей растворимого фибрина (рис. 45), которые соединяются за счет образования пептидных мостиков между боковыми радикалами лизина и глютамина. Сшитые между собой мононити фибрина образуют прочную сеть, менее подверженную фибринолизу и более устойчивую к механическим воздействиям. В такой форме фибрин не растворяется в 5-молярной мочевине и называется нерастворимым фибрином.
| Рис. 46. Организованный тромб,в котором в фибрино-вую сеть включены клетки крови |
Образовавшийся фибриновый сгусток - трехмерная молекулярная сеть, в которую включены тромбоциты, эритроциты и лейкоциты (рис. 46). Активированные тромбоциты, связанные с нитями фибрина через рецепторы GPIIb-IIIa, сокращают-
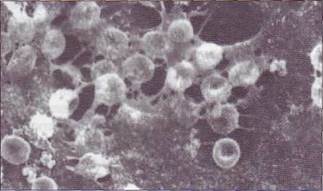
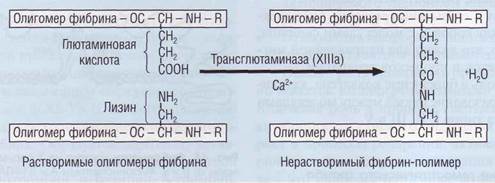
Рис. 45. Образование нерастворимого фибринапод влиянием фактора ХIIIа
Плазменные белки гемостаза
ся под действием тромбостенина (тромбоцитарно-го актомиозина) вследствие присущих им контрак-тильных свойств (см. главу «Тромбоциты»). Происходит ретракция сгустка крови. Сгусток уплотняется, из него выдавливается часть сыворотки. Формирование окончательного тромба наступает на 10-15-й минуте после полимеризации фибрина.
Если тромбоциты отсутствуют или имеют дефект GPIIb-IIIa, то ретракции кровяного сгустка не происходит и он быстро лизируется в процессе фибринолиза. При отсутствии ретракции тромба в сосудистом русле возможен отрыв тром-ботических масс и эмболия удаленных сосудов (тромбоэмболия).
Дата добавления: 2016-08-06; просмотров: 3434;











