Антитромбин и гепарин
Антитромбин (синоним - антитромбин III, AT) - гликопротеин, состоит из 432 аминокислот и имеет 4 участка гликолизации с разным количеством сиаловых кислот. Этот ингибитор формирует стабильный 1:1 комплекс с сериновыми протеа-зами плазменного гемостаза. Кроме того, AT связывается со специфическими сульфатными группами на пентасахаридных структурах гепарина.
AT синтезируется в печени и является наиболее значимым ингибитором системы свертывания крови. Активности находящегося в крови здорового человека антитромбина достаточно, чтобы ингиби-ровать в три раза больше тромбина, чем может образоваться из циркулирующего протромбина. Несмотря на это, уже при снижении активности AT в плазме ниже 60% возрастает риск патологических тромбозов. При изолированном дефиците активности AT риск тромботических проявлений возрастает пропорционально степени снижения активности. Помимо тромбина, AT ингибирует фактор Ха, а также факторы IХа, ХIа, ХIIа и калликреин.
Антитромбин по структуре гомологичен α1 -антитрипсину. В его активном центре присутствует специфическая связь Arg-Ser, которая и взаимодействует с сериновыми протеазами.
| Рис. 49. Влияние гепарина на активность фактора Ха в плазме.Гепарин существенно усиливает ингибирующий эффект антитромбина на фактор Ха |
Активность AT в десятки тысяч раз усиливается в присутствии отрицательно заряженных гли-козаминогликанов, таких, как гепарансульфат, входящих в структуру гликокаликса на поверхности эндотелиальных клеток. Аналогичное потенциру-
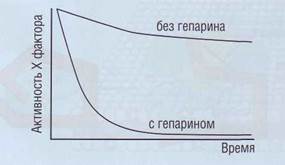
ющее действие на AT оказывает гепарин (рис. 49), вырабатываемый тучными клетками. Антикоагу-лянтное действие гепарина связано с его способностью вызывать конформационные изменения AT. Функция гепарина каталитическая. После образования эквимолярного 1:1 комплекса тромбин-антитромбин (ТАТ) гепарин может освобождаться для организации других комплексов.
Нефракционированный гепарин представляет собой смесь гепаринов различной молекулярной массы. До последнего времени он широко применялся в клинической практике как антикоагулянт. В настоящее время большее распространение получили препараты низкомолекулярного гепарина (НМГ, английская аббревиатура - LMWH), который получается из гепарина химической или энзиматической обработкой. Гепарин не только значительно усиливает активность AT, но и модулирует его ингиби-торную активность. Для стабилизации комплекса ТАТ гепарин должен быть представлен структурой, имеющей, по крайней мере, 18 моносахаридных оснований. Нефракционированный гепарин связывается одновременно как с ферментом, так и с AT, тогда как НМГ связывается только с молекулой AT (рис. 50). Нефракционированный гепарин усиливает активность AT в отношении всех сериновых про-теаз каскада свертывания крови, тогда как низкомолекулярный - в основном в отношении ф.Ха.
Наиболее эффективно AT «работает» в токе крови. В составе протромбиназного комплекса (рис. 41), содержащем также фосфолипиды, Са и ф.Vа, фактор Ха лучше защищен от ингибирова-ния комплексом АТ-гепарин.
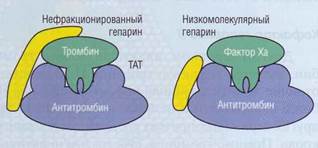
Рис. 50. Эффект нефракционированного гепарина
(молекулярная масса до 30 кДа) по стабилизации комплекса тромбин-антитромбин и низкомолекулярного гепарина (молекулярная масса 3 кДа), предпочтительно влияющего в качестве кофактора на образование комплекса фактор Ха - антитромбин, ТАТ - тромбин-антитромбино-вый комплекс
Плазменные белки гемостаза
Гепарин и НМГ широко используются для профилактики и лечения тромбозов.
Антикоагулянтное действие гепарина можно быстро и обратимо снять внутривенным введением протаминсульфата - основного белка, содержащегося в сперме рыб и ковалентно связывающегося с гепарином. Гепарин, помимо активации AT, обладает дополнительными антикоагулянтны-ми эффектами. Очень важной функцией является нейтрализация гепарином тромбоцитарного фактора 4, который освобождается из а-гранул, а также стимуляция гепарином освобождения из сосудистой стенки ингибитора внешнего пути (TFPI) и кофактора гепарина П.
Серьезным осложнением гепаринотерапии может быть развитие гепариновой тромбоцито-пении и рикошетных тромбозов (см. раздел «Тромбоцитопения, вызванная гепарином»).
Комплекс тромбин-антитромбин
Продукт взаимодействия тромбина и AT (ТАТ) - неактивный комплекс, в нем тромбин и AT быстро теряют свою активность. ТАТ удаляется из системы циркуляции печенью в течение нескольких минут. Увеличение ТАТ в системе циркуляции свидетельствует о развитии гиперкоагуляции с увеличением образования тромбина. В частности, ТАТ повышен у пациентов с гипергомоцис-теинемией, которая вызывает, по-видимому, воспалительную реакцию на уровне эндотелиальных клеток. У таких больных увеличен риск тромбо-эмболической болезни и окклюзии артериальных сосудов. После лечения фолиевой кислотой и витамином В6 ТАТ значительно снижается.
Кофактор гепарина II
Другим серпином, инактивирующим тромбин, является кофактор гепарина П. Однако, в отличие от антитромбина, кофактор гепарина II более избирателен и не ингибирует активность других сериновых протеаз системы свертывания крови. Помимо тромбина, субстратом инактивации для кофактора гепарина II являются химо-трипсин и катепсин Н.
С1-ингибитор
С1-ингибитор (Cl-Ing) - наиболее важный ингибитор факторов контактной активации (см. раз-
дел «Внутренний путь образования протромби-назы. Факторы контактной активации»). С1-ин-гибитор-высокогликозилированный серпин, ин-гибирующий факторы ХПа, ХIа, калликреин, плазмин и субкомпоненты Clr и Cls первого компонента системы комплемента.
Вклад С1-ингибитора в систему гемостаза, вероятно, не очень велик, так как его дефицит не проявляется ни кровоточивостью, ни тромбозами. Основное проявление дефицита С1-ингибитора -рецидивирующие ангионевротические отеки.
α2-макроглобулин
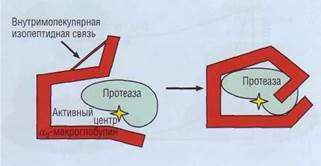
| Рис. 51. Ингибирование активных протеазза счет погружения фермента внутрь макромолекулы α2-макрогло-булина |
α2-макроглобулин - гликопротеид, неспецифический ингибитор протеаз. Это крупный белок с молекулярной массой 725 000 Да. Механизм его действия отличается от такового у серпинов. Он действует по принципу мышеловки, у которой дверца захлопывается после попадания объекта внутрь (рис. 51). Образуя связи с внутренними пептидами α2-макроглобулина, протеазы не могут расщепить такой высокомолекулярный субстрат. α2-макроглобулин имеет большую емкость по связыванию протеиназ, но относительно низкое сродство. Он включается в физиологическую инактивацию протеиназ после истощения других ингибиторов, обладающих высоким сродством, но относительно низкой емкостью. Он инактивирует большинство протеаз, включая ферменты системы свертывания крови и фибринолиза. Потребление α2-макроглобулина обычно обнаруживают в состояниях повышенной протеолитической активности, в частности при панкреатитах. У новорожденных содержание α2-макроглобулина примерно в 2 раза выше, чем у взрослых.
Плазменные белки гемостаза
Дата добавления: 2016-08-06; просмотров: 4107;











