Концентрированные растворы полимеров
При увеличении концентрации раствора до умеренной концентрации (1-5%) сегменты макромолекул равномерно распределены в растворе, что дает возможным применять модель квазикристаллической решетки к растворам полимеров. Координационные сферы макромолекул в концентрированных растворах перекрываются, а при характеристической концентрации 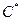 концентрация сегментов внутри сферы равна их средней концентрации в растворе. Концентрированные растворы полимеров имеют как теоретическое, так и технологическое значение.
концентрация сегментов внутри сферы равна их средней концентрации в растворе. Концентрированные растворы полимеров имеют как теоретическое, так и технологическое значение.
Через концентрированные растворы в настоящее время перерабатывается большое количество полимеров. Переработке через растворы подвергаются такие полимеры, как полиакрилонитрил производные целлюлозы, термостойкие полимеры. Значительное количество полимерной пленки и мембран производится поливом из растворов. Широко применяемые полимерные клеи также являются концентрированными растворами полимеров.
13.12. Термодинамическая равновесность растворов полимеров и подчинение их правилу фаз
До 30-х годов текущего столетия полимеры выделяли в группу лиофильных коллоидов. В этот период многие закономерности лиофобных коллоидов неправильно переносили на полимеры. Так, большое распространение в свое время получила мицеллярная теория строения растворов полимеров. Длительное время в науке господствовали ошибочные представления о неподчинении растворов полимеров правилу фаз, о неравновесности растворов полимеров. Оказалось, что наблюдаемые закономерности связаны не с термодинамическими, а с кинетическими причинами, с медленностью установления равновесия в растворах полимеров вследствие больших времен релаксации и высокой вязкости растворов. Растворы полимеров являются термодинамически равновесными системами и подчиняются правилу фаз. Правило фаз гласит, что между числом степеней свободы, т. е. Числом независимых переменных, определяющих состояние системы, 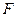 , числом компонентов,
, числом компонентов, 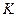 , и числом фаз,
, и числом фаз, 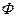 существует простая зависимость:
существует простая зависимость: 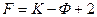
В растворах полимеров, представляющих собой конденсированные системы, в газовой фазе не принимают во внимание давление, т. к. оно не влияет на состояние системы, и для раствора полимера: 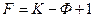
Для двухкомпонентной однофазной системы 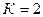 ,
, 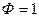 ,
, 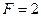 , т. е. Состояние системы однозначно определяется двумя переменными: температурой и концентрацией.
, т. е. Состояние системы однозначно определяется двумя переменными: температурой и концентрацией.
Условие равновесия двухфазной системы определяется равенством химического потенциала в обеих фазах. Аналитическое описание фазового равновесия затруднительно даже для низкомолекулярных соединений, а для растворов полимеров оно дополнительно затруднено полидисперсностью полимера. Поэтому прибегают к геометрическому описанию фазового равновесия путем построения диаграмм состояния, или фазовых диаграмм в координатах: температура – состав. Экспериментально нагревают и охлаждают раствор разной концентрации и определяют температуру фазового расслоения по помутнению раствора и составы фаз (рис. 13.10). Кривая равновесия имеет максимум и называется бинодалью. Температуре 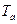 соответствуют две фазы состава
соответствуют две фазы состава 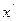 и
и 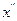 . Каждая фаза представляет собой насыщенный раствор одного компонента в другом. При повышении температуры первая фаза обогащается вторым компонентом, а вторая фаза обогащается первым компонентом, т. е. Значения концентрации компонентов в обеих фазах изменяются, приближаясь друг к другу. При некоторой температуре, называемой критической температурой смешения (
. Каждая фаза представляет собой насыщенный раствор одного компонента в другом. При повышении температуры первая фаза обогащается вторым компонентом, а вторая фаза обогащается первым компонентом, т. е. Значения концентрации компонентов в обеих фазах изменяются, приближаясь друг к другу. При некоторой температуре, называемой критической температурой смешения ( 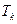 ) составы обеих фаз выравниваются, граница раздела между ними исчезает, и образуется гомогенный раствор. Кривая сосуществования фаз характеризуется значительной асимметрией, максимум смещен в сторону, малых концентраций полимера. Форма кривой зависит от молекулярной массы и полидисперсности образца.
) составы обеих фаз выравниваются, граница раздела между ними исчезает, и образуется гомогенный раствор. Кривая сосуществования фаз характеризуется значительной асимметрией, максимум смещен в сторону, малых концентраций полимера. Форма кривой зависит от молекулярной массы и полидисперсности образца.
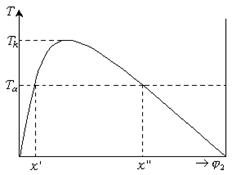
Рис. 13.10. Фазовая диаграмма раствора полимера.
Кривая распределения разбивает область абсолютно неустойчивых смесей и область устойчивого состояния. Все точки над кривой относятся к гомогенной системе, образуя область полной смешиваемости компонентов. Точки под кривой характеризуют область, в которой возникают гетерогенные флуктуации, зародыши новой фазы.
Фазовая диаграмма позволяет установить термодинамический критерий разделения растворов полимеров на разбавленные и концентрированные. Левая ветвь бинодали служит правой границей разбавленных растворов, правая ветвь бинодали является левой границей концентрированных растворов.
Бинодаль с верхней критической температурой смешения (ВКТС) соответствует полимеру, растворимость которого увеличивается с повышением температуры.
Бинодали с нижней критической температурой смешения (НКТС) характерны для полимеров, растворяющихся с выделением тепла ( 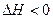 ), например целлюлозы в воде, нитроцеллюлозы в этаноле. При нагревании термодинамическое сродство компонентов уменьшается и система расслаивается. Понижение температуры приводит к повышению растворимости полимеров.
), например целлюлозы в воде, нитроцеллюлозы в этаноле. При нагревании термодинамическое сродство компонентов уменьшается и система расслаивается. Понижение температуры приводит к повышению растворимости полимеров.
Часто полимерные растворы характеризуются бинодалью с двумя критическими температурами смешения (рис. 13.11). При этом могут быть два случая: ВКТС>НКТС и НКТС>ВКТС. Положение критических температур смешения относительно друг друга определяется природой полимера и растворителя. При сильном взаимодействии полимера с растворителем, например когда полимер и растворитель сильно полярны, либо полимер диссоциирует (полиэлектролит), ВКТС>НКТС. В этом случае бинодаль имеет вид замкнутой кривой в виде овала (рис. 13.11).
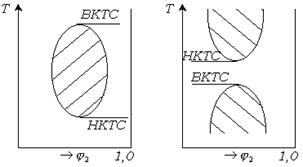
Рис.13.11 Примеры бинодалей с двумя критическими температурами смешения.
Примером системы с подобной бинодалью является система полипропиленоксид - вода. В большинстве случаев для таких систем наблюдается лишь часть замкнутой кривой.
Отсутствие низкотемпературного участка бинодали связано с кристаллизацией либо со стеклованием полимера, а отсутствие высокотемпературного участка связано с достижением температуры кипения растворителя.
По характеру фазовой диаграммы можно произвести деление жидкости на растворитель, вещество, вызывающее набухание, и нерастворитель (рис.13.12).
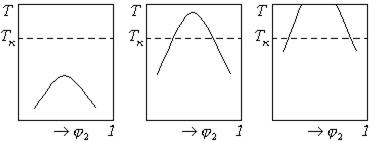
Рис. 13.12 Фазовые диаграммы для растворителя ( 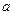 ), агента набухания (б), нерастворителя(в).
), агента набухания (б), нерастворителя(в).
Для растворителя 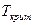 лежит ниже комнатной температуры
лежит ниже комнатной температуры 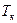 . Для агента набухания
. Для агента набухания 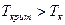 , концентрация жидкости в фазе полимера велика (б). Для нераастворителя
, концентрация жидкости в фазе полимера велика (б). Для нераастворителя 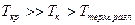 . Концентрация жидкости в фазе полимера мала.
. Концентрация жидкости в фазе полимера мала.
1 Принцип подвижного равновесия Ле Шателье гласит, что при внешнем воздействии на систему равновесие смещается в сторону процесса, уменьшающего воздействие внешнего фактора. Так при повышении температуры ускоряется процесс, идущий с поглощением тепла.
[1] Переходными называют металлы, которые содержат электроны, находящиеся на d- и f - уровнях.
Дата добавления: 2020-11-18; просмотров: 786;











