Свойства водных растворов ПАВ. Мицеллообразование
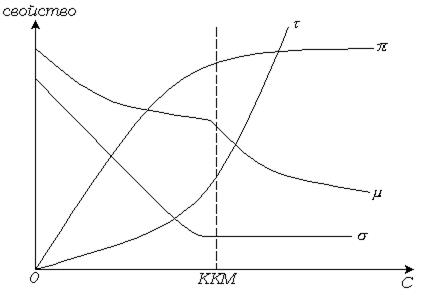
Рис. 6.2. Изменение свойств растворов ПАВ в зависимости от концентрации.
Водные растворы ПАВ проявляют необычные физико-химические свойства. В разбавленных растворах ионные ПАВ ведут себя как нормальные электролиты. При достижении определенной концентрации резко изменяются такие физико-химические свойства, как осмотическое давление, электропроводность, мутность и поверхностное натяжение (рис. 6.2).
Скорость, с которой осмотическое давление увеличивается с концентрацией, становится аномально низкой, что указывает на ассоциацию молекул. Высокое значение электропроводности при этой концентрации свидетельствует о сохранении значительной диссоциации на ионы. Резко возрастает мутность растворов, а на изотерме поверхностного натяжения появляется перелом. Резко изменяется также моющая способность растворов ПАВ.
Мак Бен объяснил наличие двух ветвей на концентрационных зависимостях свойств образованием агрегатов или мицелл ионов ПАВ, в которых липофильные углеводородные цепи ориентированы внутрь мицеллы, а гидрофильные группы находятся в контакте с водной фазой (рис. 6.3).
Рис. 6.3. Строение сферической мицеллы ПАВ в воде.
Абсцисса точки излома соответствует критической концентрации мицеллообразования (ККМ), т. е. концентрации, выше которой становится возможным образование мицелл. Одна ветвь на кривых изменения свойств растворов ПАВ характеризует молекулярное состояние ПАВ в растворе, другая соответствует коллоидному состоянию ПАВ.
Образование мицелл, подобно адсорбции, приводит к уменьшению межфазной энергии раствора ПАВ. Тепловое движение и электростатическое отталкивание между заряженными полярными группами на поверхности мицеллы препятствует образованию мицелл.
Мицеллы образуют только ПАВ, обладающие оптимальным соотношением между гидрофобной и гидрофильной частями, т. е. величиной гидрофильно-липофильного баланса (ГЛБ). К мицеллообразующим ПАВ относятся натриевые, калиевые, и аммониевые соли жирных кислот с длиной цепи 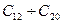 , алкилсульфаты, алкилбензосульфонаты и другие ионогенные и неионогенные ПАВ. Истинная растворимость таких ПАВ невелика и достигает тыс. долей моль/л для ионогенных и два порядка ниже для неионогенных ПАВ. При малой общей концентрации ПАВ в системе
, алкилсульфаты, алкилбензосульфонаты и другие ионогенные и неионогенные ПАВ. Истинная растворимость таких ПАВ невелика и достигает тыс. долей моль/л для ионогенных и два порядка ниже для неионогенных ПАВ. При малой общей концентрации ПАВ в системе 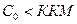 все вещество находятся в виде истинного раствора, и мицелл практически нет (рис. 6.4).
все вещество находятся в виде истинного раствора, и мицелл практически нет (рис. 6.4).
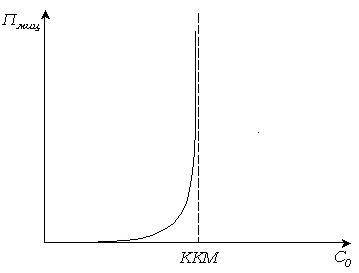
Рис. 6.4. Зависимость растворимости ионогенных ПАВ от температуры.
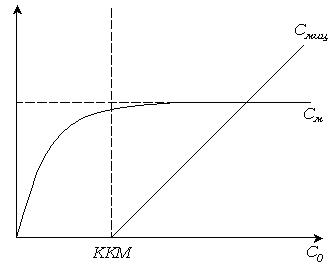
Рис. 6.5. Зависимость количества вещества в молекулярно-растворенной форме от общей концентрации.
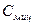 может на несколько порядков превышать
может на несколько порядков превышать 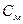 . Поэтому мицеллы являются депо, для поддержания постоянной концентрации ПАВ при его расходовании.
. Поэтому мицеллы являются депо, для поддержания постоянной концентрации ПАВ при его расходовании.
При достижении ККМ в узкой области концентраций вблизи ККМ начинается образование мицелл. Практически все вновь вводимое вещество переходит в мицеллярное состояние, повышая концентрацию вещества, находящегося в растворе.
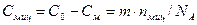
Концентрация молекулярно-растворенного вещества 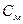 остается почти постоянной (рис. 6.5).
остается почти постоянной (рис. 6.5).
Дата добавления: 2020-11-18; просмотров: 710;











