Аллостерическая регуляция каталитической активности ферментов
Аллостерическими ферментами называют ферменты, активность которых регулируется обратимым нековалентным присоединением модулятора (активатора и ингибитора) к аллостерическому центру. Ингибиторами аллостерических ферментов часто являются конечные продукты метаболических путей, активаторами – их начальные субстраты.
Активирование происходит по принципу прямой положительной связи, а ингибирование - по принципу отрицательной обратной связи.
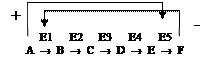
Аллостерические ферменты играют важную роль в регуляции т.к. чрезвычайно быстро реагируют на изменения среды.
Например, конечный продукт катаболизма глюкозы АТФ ингибирует аллостерически ферменты гликолиза фосфофруктокиназу и пируваткиназу. Накапливаемая в гликолизе фруктоза-1,6-ф активирует пируваткиназу, что ускоряет реакции гликолиза.
2). Регуляция каталитической активности ферментов с помощью белок-белковых взаимодействий. Выделяют 2 механизма:
а). Активация ферментов в результате присоединения регуляторных белков. Например, аденилатциклаза (Ац), которая катализирует превращение АТФ в цАМФ, активируется присоединением α-субъединицы G-белка. Этот механизм регуляции обратим.
б). Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров. Например, протеинкиназа А, активируется при диссоциации ее тетрамера на 4 субъединицы и инактивируется при обратном соединении 4 субъединиц в тетрамер.
3). Регуляция каталитической активности ферментов путем их ковалентной модификации. Регуляция активности фермента осуществляется в результате ковалентного присоединения или отщепления от него фрагмента. Она бывает 2 видов:
а). путем фосфорилирования и дефосфорилирования ферментов;
б). путем их частичного протеолиза.
а). Регуляция каталитической активности ферментов путем их фосфорилирования и дефосфорилирования. Фосфорилирование осуществляется протеинкиназами (ПК) по ОН-группе серина, треонина или тирозина регуляторный белков и ферментов. Дефосфорилирование в этих же положениях осуществляется фосфопротеинфосфатазами (ФПФ).
Введение отрицательно заряженной фосфорной группы приводит к обратимому изменению конформации и активности фермента.
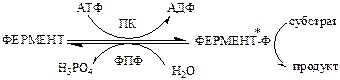
Например, под действием глюкагона и адреналина в клетках печени происходит фосфорилирование ключевых ферментов гликогенеза (гликогенсинтаза) и гликогенолиза (гликогенфосфорилаза), при этом распад гликогена активируется, а синтез ингибируется.
Инсулин наоборот вызывает в клетках печени дефосфорилирование тех же ключевых ферментов, в результате синтез гликогена активируется, а распад ингибируется.
б). Регуляция каталитической активности ферментов путем их частичного протеолиза. При участии активаторов и протеолитических ферментов происходит отщепление части молекулы фермента и его необратимая активация. Такой фермент функционирует короткий период, а затем разрушается. Подобная схема активации характерна для внеклеточных ферментов ЖКТ (пепсин, трипсин, химотрипсин и др.) и ферментов свертывающей и противосвертывающей системы крови (тромбин, фибрин, плазмин др.). Например, трипсиноген, синтезируемый в поджелудочной железе, поступает в двенадцатиперстную кишку, где энтеропептидаза кишечника отщепляет у него с N-конца гексапептид. В результате в оставшейся части молекулы фермента формируется активный центр.

Дата добавления: 2016-07-27; просмотров: 3127;











