АКТИВНОСТЬ ФЕРМЕНТОВ
1. Особенности ферментативных реакций
2. Влияние температуры на активность ферментов
3. Влияние рН на активность ферментов
4. Активаторы и ингибиторы ферментов
I. Все ферментативные реакции имеют 4 особенности
· Высокая активность ферментов;
· Обратимость действия ферментов;
· Специфичность действия ферментов;
· Лабильность (чувствительность).
Высокая активность ферментов. Ферменты обуславливают высокую скорость ферментативной реакции, которая характеризуется числом оборотов ферментов – это количество молекул субстрата, которое превращается в продукты реакции при действии одной молекулы фермента в единицу времени. Например, алкогольдегидрогеназа имеет активность 4700 ед., фосфорилаза – 50000 ед., a-амилаза – 16000 ед.
Обратимость действия ферментов установил Данилевский. Под обратимостью действия ферментов понимают образование комплекса ES и его распад, т.е. реакции с участием фермента могут идти как в одну сторону (биосинтез), так и в обратную (распад).
Специфичность действия ферментов - каждый фермент действует только на свой определенный субстрат или группу родственных субстратов. Например, инвертаза действует на сахарозу; a-амилаза – только на крахмал и декстрины; протеазы – на белки.
Существует две тачки зрения, объясняющие специфичность действия ферментов. По образному представлению Э. Фишера “фермент подходит к субстрату как ключ к замку”, т.е. топография активного центра фермента не только высокоупорядочена, но и жестко закреплена. Активной центр фермента соответствует топографии только одного единственного субстрата. Вторая точка зрения, предложена Д. Кошландом - теория индуцированного соответствия фермента и субстрата: конформация фермента, в особенности его активного центра, способна к определенным модификациям. В зависимости от конформационной подвижности активного центра фермент способен взаимодействовать либо с немногими, либо с самыми разными субстратами. Иными словами, в момент образования комплекса ЕS, происходят изменения в структуре как фермента, так и субстрата. В результате чего они адаптируются друг к другу.
Специфичность ферментов играет важную роль в процессе обмена веществ в живом организме. (Если бы фермент не имел уникальных свойств, то в живом организме не было бы обмена веществ)
По признаку специфичности ферменты делятся на 2 группы:
· Абсолютная специфичность – фермент действует только на одно-единственное вещество или катализирует только определенное превращение этого вещества;
· Относительная или групповая специфичность – ферменты действуют сразу на многие субстраты, обладающих рядом общих структурных свойств.
Лабильность (чувствительность) – все ферменты чувствительны к повышению температуры и низким значениям рН, при которых происходит потеря активности ферментов.
II. Важнейшим фактором, от которого зависит активность ферментов, является температура.
Графически зависимость скорости ферментативной реакции от температуры выглядит следующим образом:
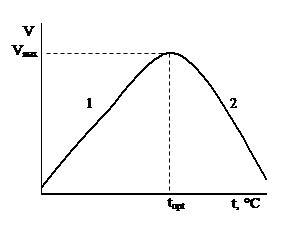 При 0°С, а тем более при температурах ниже 0°С действие большинства ферментов прекращается. Повышение температуры (кривая 1) выше 0°С способствует увеличению активности ферментов (увеличивается число столкновений реагирующих веществ). При определенной температуре фермент проявляет максимальную активность. Для большинства ферментов оптимальной температурой действия является 40-50°С. Дальнейшее увеличение температуры приводит к инактивации ферментов (уменьшения активности) вследствие термической денатурации белковой молекулы (кривая 2).
При 0°С, а тем более при температурах ниже 0°С действие большинства ферментов прекращается. Повышение температуры (кривая 1) выше 0°С способствует увеличению активности ферментов (увеличивается число столкновений реагирующих веществ). При определенной температуре фермент проявляет максимальную активность. Для большинства ферментов оптимальной температурой действия является 40-50°С. Дальнейшее увеличение температуры приводит к инактивации ферментов (уменьшения активности) вследствие термической денатурации белковой молекулы (кривая 2).
Изменение скорости реакции при повышении температуры на каждые 10°С выражают температурным коэффициентом Q10. Температурный коэффициент представляет собой отношение скорость реакции при данной температуре vt+10 к скорости реакции при температуре на 10°С ниже данной:
Vt+10
Q10 = --------
Vt
Величина Q10 для химических реакций лежит в приделах 2-4, для ферментативной реакции – между 1 и 2; Q10 ферментативных реакции заметно снижается при повышении температуры.
III. Каждый фермент проявляет своё действие в пределах довольно узкой зоны рН. Графическая зависимость активности фермента от рН имеет вид:
В кислой среде, при низких значениях рН, имеет форму ЕН2+ , в такой форме он малоактивен. При оптимуме рН фермент обладает максимальной активностью и находится в форме ЕН; при подщелачивании среды, фермент приобретает форму Е-.
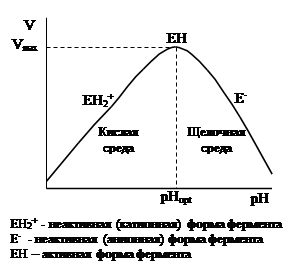 Оптимальной активности соответствует определенная область рН, причем каждый фермент имеет свое оптимальное значение рН действия (например, бактериальная a-ами-лаза имеет рН оптимум при 6, а a-амилаза микроскопических грибов – 4,7). Оптимальное значение рН связано с аминокислотным составом ферментов.
Оптимальной активности соответствует определенная область рН, причем каждый фермент имеет свое оптимальное значение рН действия (например, бактериальная a-ами-лаза имеет рН оптимум при 6, а a-амилаза микроскопических грибов – 4,7). Оптимальное значение рН связано с аминокислотным составом ферментов.
Колоколообразная форма кривой объяснится с амфотерной природой ферментов; восходящая и нисходящая ветви этой кривой являются типичными кривыми титрования и определяется значениями рК ионных групп, которые находятся в активном центре ферментов.
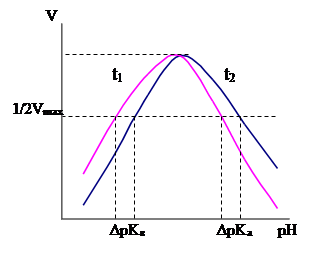 Для определения функциональных групп, входящих в активный центр фермента, необходимо определить зависимости активности этого фермента от рН при разных температурах и определить значение рК. Зная значения ΔрК для кислой и щелочной ветви зависимости v = f(pH) находят функциональные группы, которые соответствуют этому значению.
Для определения функциональных групп, входящих в активный центр фермента, необходимо определить зависимости активности этого фермента от рН при разных температурах и определить значение рК. Зная значения ΔрК для кислой и щелочной ветви зависимости v = f(pH) находят функциональные группы, которые соответствуют этому значению.
| Функциональная группа | Значение рК |
| a-Карбоксильная (-СООН) | 1,8-2,2 |
| Имидазольная | 5,0-7,8 |
| ОН-группа тирозина | 9,7-10,1 |
| a-Аминогруппа | 8,3-9,8 |
 IV. Все вещества, сопровождающие фермент в процессе реакции можно подразделит на активаторы, ингибиторы и нейтральные соединения.
IV. Все вещества, сопровождающие фермент в процессе реакции можно подразделит на активаторы, ингибиторы и нейтральные соединения.
Активаторы – химические соединения, повышающие действие ферментов (например, глютатион активизирует действие протеаз, NaCl увеличивает активность амилаз); ингибиторы – соединения, подавляющие их активность (например, группа –CN подавляет активность дыхательных ферментов, находящихся в цитохромной системе) и нейтральные соединения не оказывают никакого влияния на ферменты.
Процесс ингибирования может быть обратимым и необратимым.
Обратимые ингибиторы бывают:
· Конкурентного действия – ингибитор взаимодействует с функциональными группами активного центра ферментов. Ингибирование в данном случае зависит от концентрации субстрата: если [S] велика, то влияние ингибитора [I] может не проявляться; если же [S] мала, то ингибитор может вытеснить субстрат из соединения с ферментом, действие которого при этом затормаживается. Тройной комплекс ЕSI при конкурентном ингибировании никогда не образуется.
· Бесконкурентное ингибирование наблюдается в том случае, когда ингибитор не способен присоединяться к ферменту, не он может связываться с фермент-субстратным комплексом, переводя его в неактивную форму.
· При смешанном ингибировании ингибитор действует как на участок связывания ES, так и на каталитический центр фермента.
Дата добавления: 2016-12-09; просмотров: 6831;











