При різних значеннях рН
| рН Комплексон | ||||||||||||
| ЕДТА | 18,0 | 13,5 | 10,6 | 8,4 | 6,5 | 4,7 | 3,3 | 2,3 | 1,3 | 0,45 | 0,07 | 0,01 |
| НТА | 11,2 | 8,6 | 6,9 | 5,7 | 4,7 | 3,7 | 2,7 | 1,7 | 0,8 | 0,19 | 0,02 | 0,00 |
| ГЕДТА | 18,0 | 15,3 | 12,5 | 10,3 | 8,3 | 6,3 | 4,3 | 2,6 | 0,77 | 0,12 | 0,01 | 0,00 |
Титрування Al3+ і двозарядних катіонів важких металів у присутності катіонів лужноземельних металів проводять при рН ≈ 5, селективне титрування інших тризарядних катіонів у присутності двозарядних – при рН = 3,0 і нижче. Виходячи з цього, можна обійтися без допоміжного комплексоутворюючого реагента, який завжди необхідний при більш високих значеннях рН, для того, щоб уникнути випадіння в осад у формі гідроксиду йон, який визначається. Допоміжна комплексоутворююча речовина (наприклад, амоніак), призвела б до зниження ефективних констант стійкості комплексів йонів металів, що титруються, з ЕДТА і внаслідок цього – до погіршення селективності.
Значно більш вибірковими, у порівнянні з амінополікарбоновими кислотами, титрантами є поліаміни, які практично зв’язують у комплекс лише йони перехідних металів. Проте для практичного застосування в аналізі вони малопридатні, так як стійкість поліамінових комплексів швидко знижується із зменшенням рН середовища.
Оскільки число випадків, коли константи стійкості комплексів ЕДТА з присутніми в досліджуваному розчині йонами металів відрізняються більше ніж в 104–105 разів, мало, то доводиться перед титруванням проводити розділення йонів металів або маскування тих йонів, які заважають визначенню досліджуваного йона.
Для розділення можна осадити один із компонентів суміші з наступним відфільтровуванням осаду. При цьому застосовують осаджувачі як і в гравіметрії. Але вимоги до осаду в гравіметричному і титриметричному аналізі різні. Для титриметричних потреб необхідно лише ретельне відділення супутніх йонів металів, а не обов’язково, щоб осад мав строго стехіометричний склад. Для розділення суміші катіонів застосовують також йонний обмін на катіонітах.
Маскування будь-якого компонента розчину передбачає хімічне зв’язування його доданою маскуючою речовиною, внаслідок чого даний компонент не бере участі у наступній хімічній реакції, тобто не титрується при комплексонометричному титруванні другого компонента розчину. Маскування йона металу може відбуватися шляхом його осадження, зв’язування в комплекс, окиснення або відновлення.
Часто буває доцільним демаскувати якийсь замаскований раніше йон металу для того, щоб мати можливість його відтитрувати. Якщо є суміш двох йонів металів у розчині, то можна спочатку замаскувати один із них, а другий відтитрувати, потім демаскувати перший і визначити також і його.
У багатьох випадках демаскування можна досягти шляхом зміни рН розчину. Так, наприклад, при титруванні йонів Са2+ у сильно лужному розчині йон Mg2+ замаскований у вигляді Mg(OH)2. Наступним зниженням рН розчину до 9,0–10,0 можна демаскувати Mg2+ і відтитрувати його. При маскуванні Al3+ у вигляді алюмінат-іона можна знову зробити його доступним для титрування, якщо знизити рН розчину до 5,0.
Якщо маскування здійснюється шляхом відновлення йона, його потім можна знову окиснити, після чого знову можна його титрувати. Наприклад, йони Cu2+, замасковані тіосульфат-іонами, можна демаскувати при окисненні Cu+.
Якщо йони металів замасковані зв’язуванням їх у комплекс, то для демаскування необхідно видалити з розчину комплексоутворюючу речовину. Так, наприклад, широко застосовується демаскування Zn2+ та Cd2+ з їх ціанокомплексів. Це демаскування здійснюють шляхом додавання формальдегіду або хлоралгідрату, які реагують з HCN з утворенням нітрилу гліколевої кислоти:
4 Н+ + [Cd(CN)4]2- + 4 CH2O → Cd2+ + 4 HO–CH2–CN.
Йони Co2+, Ni2+, Cu2+, Hg2+ при цьому залишаються повністю замаскованими. Йони Zn2+ демаскують з його ціанокомплексу підкисненням розчину до рН = 6,0.
Меркуриметрія
Меркуриметричний метод титриметричного аналізу базується на реакції меркурій (ІІ)-іонів з деякими аніонами з утворенням малодисоційованих солей:
Hg2+ + 2An– = HgAn2.
За цим методом визначають йони Cl–, Br–, SCN– і деякі інші.
У меркуриметричному методі найбільш часто застосовують як робочий розчин Hg(NO3)2. Оскільки меркурій (ІІ) нітрат є нестабільною сполукою і не відповідає вимогам до первинних стандартів, його розчин стандартизують за допомогою установочної речовини – первинного стандарту NaCl:
Hg2+ + 2Cl– D HgCl2; HgCl2 + 2Cl– D [HgCl4]2-
Рівновага при титруванні хлориду розчином меркурій (ІІ) нітрату буде визначатися концентраціями реагентів і константою нестійкості HgCl2:
[HgCl4]2- D Hg2+ + 4Cl–;
 .
.
Для визначення кінця титрування у меркуриметрії застосовують індикатори натрій нітропрусид, дифенілкарбазид, дифенілкарбазон.
Після досягнення точки еквівалентності при титруванні галогенідів, тіоціанатів розчином меркурій (ІІ) нітрату йони Hg2+ у надлишковій краплі титранту реагують з натрій нітропрусидом:
Hg2+ + Na2[Fe(CN)5NO] = Hg[Fe(CN)5NO] + 2Na+.
Білий дрібнокристалічний осад меркурій(ІІ) нітропрусиду малорозчинний (ДР(Hg[Fe(CN)5NO]) = 1,0·10–10).
З цим індикатором можна проводити пряме визначення хлоридів у сильнокислих середовищах.
Індикатори меркуриметрії дифенілкарбазид і дифенілкарбазон є слабкими кислотами і виступають у розчині як кислотно-основні індикатори.
У розчині дифенілкарбазиду має місце рівновага
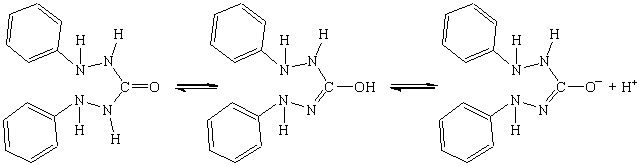
Йони Hg2+ у нейтральному або слабкокислому середовищі утворюють з цим індикатором сполуку, яка має синьо-фіолетове забарвлення:
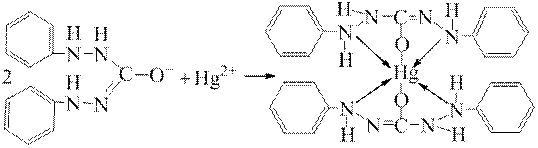
Найбільш важливим застосуванням є визначення хлорид-іонів у природних і стічних водах, а також аналіз різних кристалічних хлоридів металів.
Цей метод застосовується також для аналізу біологічних рідин, для визначення хлору в органічних сполуках після їх спалювання в кисні або сплавлення.
Цим методом можна також визначати броміди, тіоціанати і ціаніди різних металів, використовуючи як індикатор дифенілкарбазон.
При прямому меркуриметричному визначенні хлорид-іонів і бромід-іонів похибка не перевищує 0,1%.
За цим методом визначають не тільки галогеніди, ціаніди, роданіди, але й Hg2+-іони.
Багато йонів, які заважають визначенню за методом Мора і Фольгарда, не впливають на точність визначень з допомогою меркурій (ІІ) нітрату чи меркурій (ІІ) перхлорату.
Суттєвим недоліком методу є те, що солі Меркурію отруйні, робота з ними вимагає великої акуратності і дотримання необхідних заходів безпеки.
Розділ 12
Окисно-відновне титрування (Редоксиметрія)
До методів оксидиметрії відносяться такі методи, кінцеві стадії яких завершуються реакціями окиснення-відновлення.
Всі редокс-методи класифікуються в залежності від характеру основного титранту, що застосовується у конкретному випадку титрування. Якщо титрантом є окисник, то така група редокс-методів називається оксидиметрією (лат. oxidation – окиснення); якщо титрант – відновник, то методи називаються редуктометрією (лат. reduction – відновлення).
Оксидиметрія – метод визначення відновників шляхом титрування їх стандартними розчинами окисників. До таких методів відносяться: перманганатометрія, йодометрія, броматометрія, хроматометрія і інші.
Редуктометрія – метод визначення окисників шляхом титрування їх стандартними розчинами відновників. Наприклад, йодометрія, аскорбінометрія, фериметрія та ін.
За допомогою стандартних розчинів окисників і відновників можна визначати і речовини, які не мають окисно-відновних властивостей, але осаджуються у вигляді нерозчинних сполук при дії окисників чи відновників. Визначення таких речовин засноване на попередньому їх осадженні і наступному титруванні йонів, зв’язаних в осад, або надлишку окисника чи відновника, які не вступили в реакцію. Прикладом може бути визначення кальцій лактату, чи кальцій глюконату перманганатометричним методом.
Процеси окисно-відновного титрування можна представити графічно у вигляді кривої титрування, що відображає зміну окисно-відновного потенціалу Е розчину, що титрується, у міру додавання до нього стандартного (титрованого) розчину окисника або відновника.
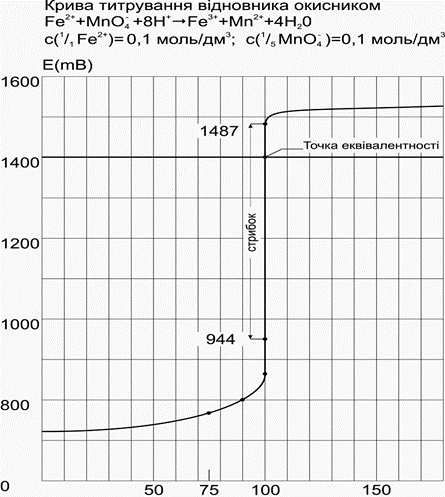
Додано титранту (см3)
Взаємодія титранту з речовиною, яка визначається, не завжди відбувається стехіометрично, що пояснюється перебігом побічних – спряжених – реакцій, з яких одна (перша) реакція відбувається самодовільно, а друга – тільки тоді, коли в цьому ж розчині відбулась перша реакція, тобто друга реакція індукована першою. Речовина, що бере участь в обох реакціях, називається актором; речовина, яка бере участь тільки в первинній реакції називається індуктором, а речовина, яка бере участь тільки у вторинній реакції називається акцептором.
Спряжені окисно-відновні реакції відзначаються тим, що всі три речовини, які беруть участь у процесі – актор, індуктор і акцептор – перетворюються в інші продукти. Так, спряжені реакції мають місце у процесах перманганатометричного титрування.
У методах окисно-відновного титрування використовують пряме і зворотне титрування, а також титрування замісника.
Пряме титрування застосовують тоді, коли реакція відбувається швидко, стехіометрично, без побічних реакцій.
Зворотне титрування застосовують у випадках, коли реакція перебігає повільно, а також для визначення летких сполук та тих, що прямо не реагують з титрантом.
Для визначення кінцевої точки титрування в редокс-методах застосовують специфічні та редокс-індикатори, а також безіндикаторні методи тоді, коли титрант має забарвлення, яке зникає при взаємодії з речовиною, що визначається (перманганатометрія); коли продукт реакції має інтенсивне забарвлення (броматометрія). До специфічних індикаторів відносяться, наприклад, крохмаль, який застосовується в йодометрії, і дає з йодом комплекс синього кольору.
Зворотні редокс-індикатори зворотно змінюють забарвлення в залежності від зміни редокс-потенціалу системи. Діапазон значень редокс-потенціалу, у якому відбувається помітна зміна забарвлення індикатора, називається інтервалом переходу забарвлення редокс-індикатора.
Вибір редокс-індикаторів здійснюється за кривими титрування при умові, що інтервал переходу забарвлення індикатора знаходиться в межах стрибка титрування.
У деяких методах використовують зворотні індикатори кислотно-основного титрування (метиловий оранжевий, метиловий червоний, індигокармін та ін.), які руйнуються надлишком титранту, внаслідок чого їх забарвлення незворотно змінюється.
Крім внутрішніх індикаторів у методах окисно-відновного титрування застосовують зовнішні і змішані індикатори.
При титруванні відновників сильними окисниками застосовують флуоресцентні і хемілюмінесцентні індикатори. До флуоресцентних індикаторів належать, наприклад, акридин, семикарбазон саліцилового альдегіду, які випромінюють видиме світло при певних значеннях pH розчину при опроміненні їх УФ світлом.
Перманганатометрія
Перманганатометрія – метод окисно-відновного титрування, у якому як окисник використовується стандартний розчин KMnO4.
Титрування перманганатом проводять у кислому, нейтральному, лужному середовищі. Переважно титрування проводять у кислому середовищі. Схеми реакцій, які при цьому протікають, мають вигляд:
 + 5ē + 8H+ D Mn2+ + 4H2O.
+ 5ē + 8H+ D Mn2+ + 4H2O.
Окисно-відновний потенціал даної системи виражається рівнянням Нернста:
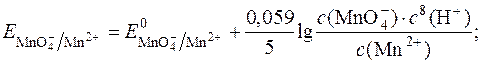
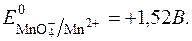
З рівняння видно, що 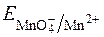 у значній мірі залежить від с(Н+).
у значній мірі залежить від с(Н+).
Інколи титрування розчином калій перманганату проводять у нейтральних чи лужних розчинах. Схеми реакцій, що при цьому відбуваються, мають вигляд:
 + 3ē + 2НОН D MnО2$ + 4ОH–;
+ 3ē + 2НОН D MnО2$ + 4ОH–;
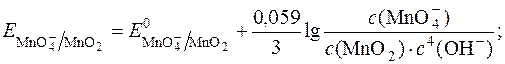
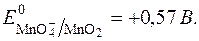
Таким чином, 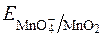 у значній мірі залежить від с(ОН–) або с(Н+).
у значній мірі залежить від с(ОН–) або с(Н+).
Процес титрування перманганатом різних неорганічних і органічних речовин дуже складний. Це пояснюється тим, що Манган у розчинах може бути в різних ступенях окиснення: 2+; 3+; 4+; 6+; 7+.
Низькозарядні йони Мангану, що утворюються у процесі відновлення MnO4–, самі здатні окиснюватись перманганатом у більш високі ступені окиснення. Щоб запобігти утворенню проміжних форм окиснення Мангану, титрування розчином перманганату слід проводити повільно, при певних значеннях pH і температури.
Перманганатом швидко окиснюються щавлева кислота, H2O2, HI, H2SO3, H2S, HNO2, Na2S2O3, роданіди, а також йони металів у нижчих ступенях окиснення (Fe2+, Mn2+, Cr2+ та ін.).
У перманганатометрії для визначення речовин, що повільно окиснюються, використовують титрування у кислому середовищі методом зворотного титрування. До розчину досліджуваної речовини додають точно відому кількість перманганату, взятого у надлишку, а потім надлишок, що не пішов на окиснення досліджуваної речовини, відтитровують стандартним розчином відновника (наприклад щавлевої кислоти).
При титруванні у лужному середовищі неорганічних і органічних речовин на першій стадії реакції окиснення-відновлення спочатку утворюється манганат:
 + ē D
+ ē D 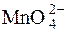 .
.
Редокс-потенціал такої системи має вираження:
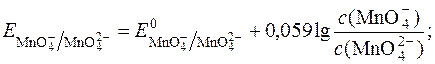
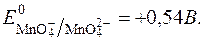
З рівняння реакції видно, що редокс-потенціал не залежить від pH.
На другій стадії окиснення-відновлення манганат відновлюється до MnO2:
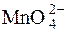 + 2ē + 2HOH D MnO2$ + 4OH–.
+ 2ē + 2HOH D MnO2$ + 4OH–.
Редокс-потенціал такої системи визначається:
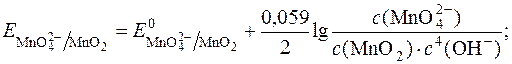
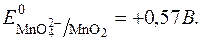
З рівняння видно, що редокс-потенціал 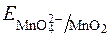 залежить від pOH чи pH. Оскльки концентрація твердого осаду MnO2 постійна, то:
залежить від pOH чи pH. Оскльки концентрація твердого осаду MnO2 постійна, то:
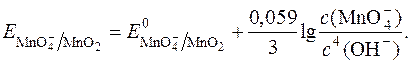
Відносно легко окиснюються перманганатом у лужному середовищі форміати, йодиди, йодати, ціаніди, роданіди, багато органічних сполук. У лужному середовищі перманганат не окиснює оксалати.
Молярна маса еквівалента перманганату при титруванні у кислому середовищі дорівнює: M( 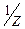 )=
)= 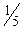 M, а в нейтральному і лужному М(
M, а в нейтральному і лужному М( 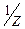 )=
)= 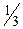 M.
M.
Дата добавления: 2020-10-14; просмотров: 673;











