Розрахунки у гравіметричному аналізі
Наприклад, необхідно визначити вміст Феруму у досліджуваному зразку. Для цього точну (аналітичну) наважку зразка розчиняють у відповідному розчиннику, переводять Ферум у стан Fe3+, осаджують ці йони у формі Fe(ОН)3 (осаджувана форма), промивають осад, висушують і переводять Ферум у гравіметричну форму – Fe2О3. Далі зважують гравіметричну форму з точністю до 0,0002г на аналітичних терезах і розраховують вміст Феруму у даній наважці гравіметричної форми за формулою:
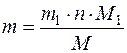 ,
,
де m – маса Феруму в гравіметричній формі, г;
m1 – маса гравіметричної форми, г;
M1 – молярна маса Феруму, г/моль;
M – молярна маса гравіметричної форми, г/моль;
n – кількість молів Феруму в молі гравіметричної форми.
Потім розраховують відсотковий вміст Феруму в досліджуваному зразку:
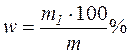 ,
,
де m1 – маса Феруму в наважці гравіметричної форми, г:
m – маса взятого для дослідження зразка, г.
Кількість осаджувача визначається вмістом досліджуваного елемента в речовині, а це залежить від величини наважки досліджуваної речовини. Величина наважки впливає, як вже зазначалось, на точність аналізу. Чим більша величина наважки досліджуваної речовини, тим вища точність аналізу.
Оптимальна маса кристалічних осадів становить близько 0,5г, а аморфних осадів – близько 0,2-0,3г. Виходячи з цього, можна розрахувати оптимальну масу наважки досліджуваної речовини.
Наважка досліджуваної речовини визначається, виходячи з рівнянь реакцій.
Для кристалічних осадів:
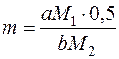 ,
,
де m – маса наважки досліджуваної речовини, г;
M1 – молярна маса досліджуваної речовини, г/моль;
M2 – молярна маса гравіметричної форми, г/моль;
0,5 – оптимальна маса наважки для кристалічних осадів, г;
a, b – коефіцієнти в рівнянні реакції переходу досліджуваної речовини в гравіметричну форму.
Для аморфних осадів:
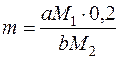
де m – маса наважки досліджуваної речовини, г;
M1 – молярна маса досліджуваної речовини, г/моль;
M2 – молярна маса гравіметричної форми, г/моль;
0,2 – оптимальна маса наважки для аморфних осадів, г;
a, b – коефіцієнти в рівнянні реакції переходу досліджуваної
речовини в гравіметричну форму.
Розрахунки об’єму розчину осаджувача
Розрахунки об’єму розчину осаджувача проводять, виходячи з рівняння реакції між речовиною, що визначається, і осаджувачем. Наприклад:
ВаСl2 + H2SO4 " BaSO4 + 2HCl
Йони Ва2+ осаджуються розчином сульфатної кислоти.
Масу осаджувача (сульфатної кислоти), необхідну для осадження Ва2+-іонів із зразка ВаCl2, розраховують за формулою:
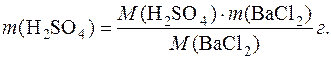
Для визначення об’єму розчину осаджувача треба знати його концентрацію і густину розчину.
У загальному вигляді для розрахунку об’єму розчину осаджувача користуються формулою:
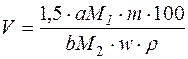 ,
,
де V – об’єм розчину осаджувача, см3;
m – наважка зразка досліджуваної речовини, г;
M1 – молярна маса осаджувача, г/моль;
M2 – молярна маса досліджуваної речовини, г/моль;
w – масова частка осаджувача в розчині осаджувача, %;
ρ – густина розчину осаджувача, г/см3;
1,5 – оптимальний надлишок осаджувача, см3;
a, b – коефіцієнти, що визначаються з рівнянь реакцій.
Відношення молярної маси компонента, що визначається, до молярної маси гравіметричної форми називається фактором перерахунку або гравіметричним множником.
Наприклад, визначають вміст йонів Ва2+ у досліджуваній речовині шляхом переведення їх у гравіметричну форму ВаSO4. Тоді:
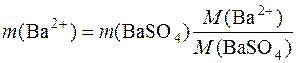 .
.
Але 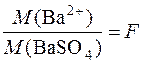 (гравіметричний множник).
(гравіметричний множник).
Отже, можна записати:
m(Ba2+) = m(BaSO4)·F.
При розрахунку гравіметричного множника слід враховувати коефіцієнти в рівняннях реакцій переходу досліджуваної речовини у гравіметричну форму.
Розділ 7
Задачі з гравіметричного аналізу
Дата добавления: 2020-10-14; просмотров: 580;











