Класифікація методів гравіметричного аналізу
Методи виділення. Компонент, який визначається, кількісно виділяють у вільному стані з досліджуваної речовини і зважують на аналітичних терезах. Прикладом такого визначення є визначення процентного вмісту золи у твердому паливі.
Методи осадження. Компонент, що визначається, кількісно осаджують хімічними способами у вигляді малорозчинної хімічної сполуки строго визначеного складу. Виділений осад промивають, висушують або прожарюють. При цьому осад у більшості випадків перетворюється у нову речовину точно відомого складу, яку і зважують на аналітичних терезах. При такому методі аналізу розрізняють дві форми речовини, яка аналізується: осаджувану форму, тобто форму, у вигляді якої осаджують досліджувану речовину, і гравіметричну форму, тобто форму, у вигляді якої досліджувану речовину зважують. Інколи гравіметрична форма може бути такою ж як і осаджувана. Наприклад, при визначенні йонів 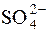 гравіметричним методом їх осаджують йонами Ва2+. При цьому утворюється малорозчинний ВаSO4. Його відділяють фільтруванням від розчину. Отже, осаджуваною формою
гравіметричним методом їх осаджують йонами Ва2+. При цьому утворюється малорозчинний ВаSO4. Його відділяють фільтруванням від розчину. Отже, осаджуваною формою 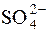 -іонів є BaSO4. Потім осад BaSO4 висушують, прожарюють. При цьому ніяких змін з BaSO4 не відбувається. Прожарений BaSO4 є гравіметричною формою йонів SO42–.
-іонів є BaSO4. Потім осад BaSO4 висушують, прожарюють. При цьому ніяких змін з BaSO4 не відбувається. Прожарений BaSO4 є гравіметричною формою йонів SO42–.
В інших гравіметричних методах визначення осаджувана форма речовини відрізняється від гравіметричної форми. Наприклад, при визначенні йонів Fe3+:
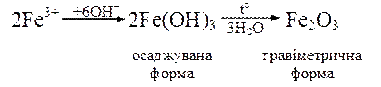
Методи відгонки. За цим методом компонент, який визначається, кількісно відганяють як летку сполуку. Частину, яку визначають, відділяють нагріванням досліджуваної речовини або дією відповідних реагентів, що супроводжується виділенням летких продуктів. Методи відгонки бувають прямі і непрямі.
|
CaCO3 + 2H+ " CO2# + Ca2+ + H2O
CO2 + 2NaOH " Na2CO3 + H2O
При непрямих методах відгонки визначають масу залишку речовини після повного видалення речовини, яка визначається. Різниця маси до і після відгонки досліджуваної речовини є кількість компонента, який визначається. Наприклад, визначення кристалізаційної води:
|
Перевагою гравіметричних методів є велика точність визначення. Гравіметричний аналіз дозволяє робити визначення з точністю до 0,005%, що перевищує точність титриметричних методів. Але суттєвим недоліком гравіметрії є велика тривалість визначень.
При правильних операціях гравіметричного аналізу похибка визначення визначається точністю зважування. При однаковій абсолютній похибці зважування велика наважка вихідної речовини дає більшу відносну точність результату аналізу, що виражається в процентах. Чим більша наважка досліджуваної речовини, тим вища відносна точність результатів аналізу.
Для розрахунку наважки треба знати приблизний вміст компонентів у досліджуваній пробі речовини, яка аналізується, або формулу цієї речовини. Осад, що одержується, не повинен бути дуже великим, бо робота з таким осадом потребує багато часу і викликає технічні труднощі. У той же час, величина осаду повинна бути достатньою для того, щоб було зручно з ним працювати. Крім того, дуже малі наважки є причиною значних відносних похибок при зважуванні.
У гравіметричному аналізі допустима похибка при зважуванні не повинна перевищувати 0,1%. Мінімальна наважка, яку можна зважувати на звичайних аналітичних терезах, не повинна бути меншою 0,1г. Чим менший процентний вміст досліджуваного компонента в пробі, тим більшою повинна бути наважка. Від точності, з якою взята наважка досліджуваної речовини, залежить достовірність результатів аналізу. Зважування твердих речовин проводять на годинниковому склі чи в бюксах, а рідких речовин – у маленьких колбах (1-2см3), крапельницях.
Для осадження кристалічних і аморфних осадів кількість розчину осаджувача слід брати приблизно у 1,5 рази більше розрахованого. Для досягнення повноти осадження необхідний надлишок осаджувача і небажані сторонні електроліти, які зменшують коефіцієнти активностей йонів малорозчинного електроліту, що призводить до зростання розчинності осаду. Разом з тим, надмірний надлишок осаджувача може призвести до часткового розчинення осаду внаслідок комплексоутворення і сольового ефекту. Крім того, надлишок осаджувача збільшує забрудненість осаду в результаті співосадження.
Для одержання кристалічних осадів використовують розведені розчини осаджувача, а для аморфних осадів–концентровані розчини осаджувача.
У більшості випадків осадження проводять при нагріванні на водяній чи повітряній бані. Не слід доводити розчин до кипіння. Осаджувач додають повільно краплинами при безперервному перемішуванні розчину скляною паличкою, але так, щоб паличка не торкалась стінок і дна стакана і не дряпала скло. Кожного разу, коли паличку виймають із стакана, її слід промити дистильованою водою над стаканом. Осаджувач слід приливати по стінці стакана. Коли осад збереться на дні і рідина над осадом стане прозорою, до неї додають декілька крапель осаджувача, щоб впевнитись у повноті осадження. Осаджений кристалічний осад не слід одразу відфільтровувати, його необхідно залишити на декілька годин (приблизно 6 год.) на водяній бані у накритому годинниковим склом стакані для дозрівання.
Повнота осадження досліджуваного йона зовсім не означає, що у розчині над осадом зовсім немає цих йонів. Концентрації йонів малорозчинного електроліту у розчині над осадом визначаються добутком розчинності цієї малорозчинної сполуки. Наприклад, йони 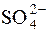 осаджуються йонами Ва2+ у вигляді ВаSO4. Концентрація йонів
осаджуються йонами Ва2+ у вигляді ВаSO4. Концентрація йонів 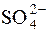 і Ва2+ у розчині над осадом можуть бути визначені:
і Ва2+ у розчині над осадом можуть бути визначені:
ДР(ВаSO4) = [Ba2+]·[ 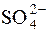 ].
].
Осадження вважається повним, якщо у розчині залишається маса речовини, менша, ніж чутливість аналітичних терезів, тобто менша, ніж 1,0·10–4г. Це значення не перевищує погрішності зважування і таким чином, не може змінити показання аналітичних терезів. Якщо молярну масу сполуки, яка осаджується, прийняти рівно 100г/моль і об’єм розчину 1дм3, то молярна концентрація речовини, яка осаджується, у розчині над осадом становитиме 1,0·10–6моль/дм3. Це значення часто приймається як кількісний критерій повноти осадження. Знайдемо, при якій концентрації йонів Ва2+ сульфат-аніон буде повністю осаджений з розчину, якщо повноту осадження вважати при [ 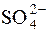 ]£1,0·10–6моль/дм3.Підставляючи це значення у вираження добутку розчинності, отримуємо:
]£1,0·10–6моль/дм3.Підставляючи це значення у вираження добутку розчинності, отримуємо:
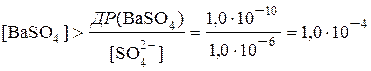 моль/дм3
моль/дм3
Значення 1,0·10–4 є рівноважною концентрацією йонів Ва2+ у розчині після осадження і не включає ту кількість речовини Ва2+, яка була використана на утворення осаду.
Добуток розчинності залежить від температури. З підвищенням температури добуток розчинності зростає. Таким чином, з точки зору повноти осадження низька температура сприяє осадженню. Але при дуже малих значеннях ДР вплив температури на повноту осадження є дуже незначним, практично не суттєвим, так як повнота осадження досягається при всіх температурах.
Аморфні осади осаджують з гарячих концентрованих розчинів і концентрованими розчинами осаджувача. Осадження проводять швидким додаванням осаджувача, що дає можливість отримувати осади з мінімальною поверхнею. Коли осадження закінчено, у стакан додають 100-150см3 гарячої води і швидко фільтрують.
У гравіметричному аналізі застосовують беззольні фільтри, які згорають майже повністю. Маса золи, що залишається, складає 0,00003-0,00007г. При проведенні дуже точних аналізів, масу золи, яка вказана на обгортці пачки фільтрів, враховують при розрахунках.
Інколи осади відділяють від розчину, використовуючи пористі скляні фільтри чи спеціальні лійки з пластинками з пористого скла.
У залежності від розмірів частинок отриманого осаду застосовують паперові фільтри різного ступеня пористості: синя стрічка–для дрібнозернистих осадів; біла стрічка–для осадів середньої зернистості; червона стрічка–для крупнозернистих і аморфних осадів. Розмір фільтра визначається величиною осаду, а не об’ємом рідини, яка фільтрується. Тільки третина фільтра повинна бути заповнена осадом. Розмір лійки підбирають так, щоб краї фільтра були на 0,5-1см нижче краю лійки. При зливанні рідини на фільтр користуються скляною паличкою, але яка не повинна торкатися фільтра.
Для промивання осадів на фільтрі використовують промивні рідини. Рідину для промивання вибирають у залежності від властивостей осаду. Найчастіше використовують дистильовану воду, у яку додають невелику кількість речовин, що понижують розчинність осаду і запобігають його розчиненню.
Але ці речовини повинні легко видалятися з осаду при підготовці його до зважування. При визначенні катіонів, осаджуваних у вигляді кристалічних осадів, промивання проводять розбавленими розчинами солей амонію, які мають з осадом загальний аніон. Сіль амонію, що залишилася в осаді після промивання, звітрюється при наступному прожарюванні осаду.
Не можна переривати процес промивання осаду. Якщо непромитий осад залишити на деякий час на фільтрі, то осад швидко затвердіє, розтріскається на частини і тоді стане неможливо промити його повністю.
Для перевірки повноти промивання вміщують декілька крапель промивної рідини у пробірку чи на годинникове скло і виконують чутливу якісну реакцію на один із тих йонів, які повинні бути відмиті від осаду.
Для отримання гравіметричної форми досліджуваної речовини осад повинен бути висушений у сушильній шафі чи прожарений до постійної маси. Осади прожарюють у фарфорових, кварцових і платинових тиглях. Тигель ретельно промивають, сушать і прожарюють у муфельній чи тигельній печі. Тигель прожарюють 10–15 хвилин, виймають його з печі підігрітими тигельними щипцями (щоб тигель не тріснув від перепаду температур) і обережно ставлять в ексикатор для охолодження. Ексикатор закривають пришліфованою скляною кришкою.
Коли тигель охолоне до кімнатної температури приблизно через 30-40хв. його виймають холодними щипцями з ексикатора і зважують на аналітичних терезах з точністю до 0,0002г. Прожарювання тигля з осадом проводять не менше двох раз. Якщо різниця результатів двох паралельних зважувань буде не більше 0,0002г, то прожарювання вважається закінченим.
Перед прожарюванням осаду його треба підготувати до цієї операції. Лійку з мокрим фільтром і осадом накривають зверху листочком паперу, проколотим у декількох місцях булавкою, вміщують у сушильну шафу і підсушують при температурі близько 100˚С. Потім лійку з фільтром виймають із сушильної шафи, фільтр з осадом згортають і переносять у зважений тигель. Тигель ставлять на нагрівач і обвуглюють фільтр так, щоб папір не загорався, а тлів. При горінні фільтра полум’ям частинки осаду можуть бути винесені з тигля, що призведе до втрат. Після обвуглювання фільтра осад прожарюють у муфельній чи тигельній печі до постійної маси.
Висушену чи прожарену гравіметричну форму досліджуваної речовини зважують на аналітичних терезах.
У гравіметричному аналізі дуже важливою операцією є утворення осаду. Від якості, форми, структури і ступеня чистоти отримуваних осадів у значній мірі залежить точність і надійність результатів аналізу.
Форма, структура і ступінь чистоти утворюваного осаду залежать від умов осадження і головним чином від швидкості осадження, від концентрації осаджуваної речовини, осаджувача, тривалості осадження, температури, перемішування, розчинності утворюваних осадів, pH середовища та ін.
При повільному осадженні утворювані первинні кристали встигають правильно орієнтуватися один по відношенню до іншого, в результаті утворюються правильної форми крупні кристали. Чим менш розчинна речовина, тим швидше утворюються осади і дрібніші кристали. Чим більша швидкість утворення осаду, тим швидше порушується правильна орієнтація при кристалізації. При швидкому осадженні одразу з’являється багато центрів кристалізації. У результаті утворюється багато дрібних кристалів. Дрібні кристали можуть збиратись у пластівці, в яких кристалічну структуру можна виявити лише під мікроскопом.
Нарешті, при ще більшій швидкості осадження первинні центри кристалізації не встигають правильно орієнтуватися і розташовуються хаотично. У результаті утворюються аморфні осади.
Випадінню осаду передує пересичення розчину. У пересиченому розчині утворюються зародки кристалів осаджуваної речовини, які у міру дозрівання осаду збільшуються. Швидкість утворення цих зародків і їх число залежать від ступеня пересичення. Чим більше пересичення, тим більше зародків. Тому при осадженні з концентрованих розчинів утворюються дрібнокристалічні або аморфні осади.
Для зменшення числа центрів кристалізації у розчині у відповідності до формули:
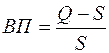
де ВП – відносне пересичення;
Q – концентрація компонента, що осаджується;
S – розчинність компонента, що осаджується,
треба зменшити Q і збільшити S.
Для цього перед осадженням багатьох речовин розчин рекомендується розбавити для зменшення Q і нагріти для збільшення S, а також ввести електроліт, найчастіше солі амонію, для збільшення S або для цього ж підкислити розчин.
Осадження в кількісному аналізі майже завжди ведуть з кислих розчинів. Осаджувачами часто виступають аніони слабких кислот, концентрацію яких можна регулювати зміною pH розчину. При деякому значенні pH досягається добуток розчинності малорозчинного електроліту і починається випадіння осаду.
Осадження із розбавлених розчинів внаслідок малої кількості зародків кристалів відбувається повільніше і у процесі осадження дрібні кристали ростуть. При осадженні із розбавлених розчинів випадають крупнокристалічні осади.
При перемішуванні розчину число зародків кристалів зменшується і створюються умови для росту крупних кристалів. Тому осадження необхідно вести при перемішуванні розчину.
При нагріванні розчинність осадів збільшується і крупні кристали утворюються швидше. Отже, осадження необхідно вести з гарячих розчинів гарячими розчинами осаджувача.
При стоянні осаду, над яким є маточний розчин, у процесі дозрівання крупні кристали ростуть, а дрібні розчиняються.
Вимоги до осадів
Сполука, у вигляді якої осаджують одну із складових частин досліджуваного розчину, повинна бути практично нерозчинна у середовищі, з якого ведеться осадження. Практично нерозчинною вважають таку сполуку, розчинність якої не перевищує 10–5моль/дм3. Щоб зменшити розчинність осаду діють надлишком осаджуючого реактиву.
Розчинність малорозчинних солей у системі осад-розчин може підвищуватись при додаванні до системи інших сильних електролітів. Це явище називається сольовим ефектом.
Причиною цього ефекту є те, що при додаванні до насиченого розчину малорозчинного електроліту розчину сильного електроліту, який не має з осадом однойменних йонів, йонна сила розчину підвищується. Внаслідок цього коефіцієнти активності йонів малорозчинного електроліту у розчині зменшуються і стають меншими від одиниці. Це призводить до того, що розчинність малорозчинного електроліту стає більшою величини добутку розчинності цього електроліту в чистій воді.
Таким чином, за теорією сильних електролітів сольовий ефект обумовлений зменшенням коефіцієнтів активності внаслідок підвищення йонної сили розчину при додаванні сторонніх електролітів.
Внаслідок того, що йонна сила розчину залежить не тільки від концентрації, але і від величини зарядів йонів, то різні електроліти, додані в однаковій кількості, дають різний сольовий ефект.
Щоб розрахувати за масою осаду або за його гравіметричною формою вміст елемента, що визначається, який виділяється в осад, гравіметрична форма осаду повинна відповідати певному постійному хімічному складу. Сполуки змінного складу, якщо вони навіть малорозчинні, непридатні для гравіметричного аналізу.
Осадження треба проводити в умовах, які забезпечують отримання осаду, який, по можливості, має кристалічну структуру. Осад кристалічної структури не повинен захоплювати сторонніх домішок з розчину, що аналізується, тобто осад повинен бути хімічно чистим.
Осадження малорозчинної сполуки повинно бути по можливості специфічним і не супроводжуватись утворенням осадів інших супутніх елементів.
Таким чином, осад повинен бути практично нерозчинним, мати постійний склад і структуру, що забезпечує успішне фільтрування, промивання і перетворення його у певну гравіметричну форму.
Причиною забруднення осадів є співосадження. Співосадження обумовлено схильністю деяких сполук, добре розчинних у даному розчиннику, осаджуватись під час утворення осаду разом з малорозчинними сполуками, що випадають в осад. Наприклад, відносно добре розчинний магній оксалат осаджується разом з малорозчинним кальцій оксалатом.
Співосадження може бути наслідком того, що утворюється хімічна сполука між осаджуваною речовиною і присутніми у розчині домішками; утворюються змішані кристали, що складаються із основної сполуки і домішок, які кристалізуються в одній і тій же кристалічній формі.
Забруднюються осади також внаслідок адсорбції на їх поверхнях домішок. Чим більша поверхня осаду, тим більше забруднення осаду. До адсорбції більш схильні осади з розвиненою поверхнею, тобто аморфні осади.
Процес адсорбції зворотний, тобто адсорбовані частинки знаходяться у рівновазі з частинками в розчині. Залежність кількості поглинутої речовини від концентрації розчину при постійній температурі називається ізотермою адсорбції. Ця залежність може бути виражена рівнянням Ленгмюра:
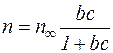 ,
,
де n – кількість адсорбованої речовини за умови рівноваги;
n∞ – максимально можлива кількість речовини, яка може бути
адсорбована;
b – постійна величина;
c – концентрація речовини в розчині.
Адсорбція йонів на поверхні осаду описується рівнянням Ленгмюра, проте має деякі особливості у порівнянні з адсорбцією молекул. Ці особливості пов’язані з вибірковою адсорбцією йонів йонним кристалом, а також із зарядом йонів. У відповідності з правилом Панета-Фаянса-Гана осад адсорбує з розчину ті йони, які утворюють найменш розчинну або найменш дисоційовану сполуку з одним із йонів осаду. У першу чергу на поверхні осаду адсорбуються йони, що входять до складу осаду і є у розчині у надлишку. Наприклад, при осадженні сульфат-іонів йонами Ва2+ з початку і до повного осадження ВаSO4 на осаді будуть адсорбуватися 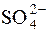 -іони, так як в цей час вони є у надлишку, а після повного осадження ВаSO4, коли до розчину додається надлишок барій хлориду, адсорбуватись будуть вже йони Ва2+. Ці йони утворюють первинний шар, який досить міцно зв’язаний з осадом. До йонів первинного шару притягуються йони протилежного заряду, які утримуються менш міцно і утворюють так званий дифузний шар. Протиіонами вторинного шару є йони, які утворюють найменш розчинну або найменш дисоційовану сполуку з йонами первинного шару. Адсорбція йона збільшується із зростанням його заряду.
-іони, так як в цей час вони є у надлишку, а після повного осадження ВаSO4, коли до розчину додається надлишок барій хлориду, адсорбуватись будуть вже йони Ва2+. Ці йони утворюють первинний шар, який досить міцно зв’язаний з осадом. До йонів первинного шару притягуються йони протилежного заряду, які утримуються менш міцно і утворюють так званий дифузний шар. Протиіонами вторинного шару є йони, які утворюють найменш розчинну або найменш дисоційовану сполуку з йонами первинного шару. Адсорбція йона збільшується із зростанням його заряду.
Причиною забруднення осаду може бути оклюзія – захоплення утворюваним осадом розчинних домішок, що спостерігається при швидкому рості кристалічних осадів. При оклюзії забруднення осаду відбувається не тільки на поверхні, але і всередині його кристалів.
Одною з основних причин оклюзії є нерівноважна адсорбція, коли швидкість росту частинок осаду перевищує швидкість установлення адсорбційної рівноваги. Наприклад, при осадженні йонів 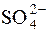 йонами Ва2+ на початку процесу, коли ще не всі сульфат-іони осадженні, йони
йонами Ва2+ на початку процесу, коли ще не всі сульфат-іони осадженні, йони 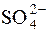 будуть адсорбуватись на поверхні ВаSO4 у первинний шар, а у вторинний будуть притягуватись протиіони – катіони домішок. При повільному додаванні осаджувача ВаCl2 адсорбовані на осаді катіони домішок внаслідок зміщення адсорбційної рівноваги будуть заміщуватись на йони Ва2+ і кристали ВаSO4 будуть рости. Якщо ж розчин осаджувача ВаCl2 додавати швидко, зміщення адсорбційної рівноваги відбувається лише частково і адсорбовані йони (катіони домішок) будуть частково захоплені всередину кристалу ВаSO4.
будуть адсорбуватись на поверхні ВаSO4 у первинний шар, а у вторинний будуть притягуватись протиіони – катіони домішок. При повільному додаванні осаджувача ВаCl2 адсорбовані на осаді катіони домішок внаслідок зміщення адсорбційної рівноваги будуть заміщуватись на йони Ва2+ і кристали ВаSO4 будуть рости. Якщо ж розчин осаджувача ВаCl2 додавати швидко, зміщення адсорбційної рівноваги відбувається лише частково і адсорбовані йони (катіони домішок) будуть частково захоплені всередину кристалу ВаSO4.
Крім нерівноважної адсорбції причиною оклюзії може бути механічний захват домішок чи розчинника всередину кристалу при утворенні осаду.
Для отримання чистих осадів їх промивають дистильованою водою або відповідними розчинниками, а також переосаджують. Переосадження полягає в розчиненні отриманого осаду з наступним його повторним осадженням.
Крупнокристалічні осади, які легко фільтруються, промивають безпосередньо на фільтрі. Аморфні осади перед перенесенням на фільтр промивають декантацією, зливаючи прозору рідину над осадом через фільтр і знову змучуючи осад промивною рідиною і знову зливаючи її. Промивання декантацією часто застосовують при переосадженні. При цьому первинний осад весь не переносять на фільтр, а після промивання декантацією розчиняють і переосаджують.
Осад на фільтрі промивають невеликими порціями промивної рідини, так як при одному і тому ж об’ємі промивних рідин багаторазова промивка невеликими порціями є більш ефективною, ніж при меншому числі разів великими порціями рідини.
Для промивання осадів воду застосовують рідко. Зазвичай беруть розчин солі амонію, що має загальний йон з осадом, розведений розчин амоніаку чи нітратної кислоти або якогось іншого електроліту. При виборі промивної рідини враховується розчинність осаду, можливість гідролізу при промиванні і схильність осаду до пептизації. Щоб зменшити втрати при промиванні осаду за рахунок розчинності, до промивної рідини вводять електроліт, що має загальний йон з осадом. За правилом добутку розчинності наявність у розчині загального йона буде знижувати розчинність осаду.
Дата добавления: 2020-10-14; просмотров: 829;











