ФЕРМЕНТАТИВНЫЕ (БИОХИМИЧЕСКИЕ) СВОЙСТВА И ПРИНЦИПЫ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ
Цель занятия.Ознакомить студентов с методами изучения ферментативной активности и принципами идентификации микроорганизмов.
Оборудование и материалы. Засеянные среды Гисса (глюкоза, лактоза, сахароза и т.д.) с признаками кислото- и газообразования, культуры Е. coli на МПБ в пробирках, реактив Эрлиха, культуры В. subtilis на молоке, МПЖ, культуры S. aureus на МПА в пробирках, 3%-й раствор перекиси водорода и другие тесты, результаты определения ферментативной активности культур Е. coli и S. typhimurium на ПБДЭ-пластинах, карточки с описанием свойств отдельных видов бактерий для работы с определителями.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Изучение ферментативной активности микроорганизмов. В пределах семейства у представителей разных родов можно обнаружить как общие для семейства, так и специфические для родов наборы ферментов. У микроорганизмов разных видов в пределах одного рода есть общие (родовые) и специфические для отдельных видов ферменты. Таким образом, каждый вид микроорганизмов характеризуется специфическим набором ферментов, поэтому определение ферментного спектра — важнейший этап идентификации микроорганизмов.
О наличии того или иного фермента судят по способности микроорганизмов воздействовать на известный субстрат. Присутствие фермента регистрируют по изменению физического состояния субстрата (разжижение желатины), закислению питательной среды (среды Гисса с углеводами), образованию определенных продуктов метаболизма (индол, сероводород, аммиак) и т.д.
Наиболее распространены следующие методы регистрации ферментативной активности микроорганизмов.
Выявление сахаролитической активности микроорганизмов. В состав дифференциально-диагностических углеводных сред (среды Гисса — см. тему 7) входят различные соединения, которые можно условно назвать сахарами: моносахариды, полисахариды, многоатомные спирты. При утилизации углеводов в качестве конечных продуктов образуются кислоты и газообразные продукты. Соответственно расщепление углевода регистрируют по изменению рН среды и выделению газообразных продуктов. Закисление питательной среды улавливают при помощи различных индикаторов.
Индикатор BP, входящий в состав сухих сред Гисса, меняет цвет от розового в щелочной среде через серый при нейтральном рН до голубого или ярко-синего в кислой среде.
Индикатор Андрэдэ (кислый фуксин —0,5 г, 1%-й раствор гидроксида натрия — 16 мл, дистиллированная вода — 84 мл) при закислении дает покраснение среды. В жидких средах Гисса образование газов при утилизации субстрата улавливают при помощи поплавков («газовок») — стеклянных трубочек, запаянных в верхнем конце и помещенных в пробирки. В «газовках» скапливаются газы, вытесняющие жидкую питательную среду; в полужидких средах Гисса газообразные продукты остаются в толще среды в виде пузырьков.
Ферментация углеводов иногда происходит медленно, поэтому предварительный учет результатов проводят через 24...48 ч, а окончательный — через 10...14 сут инкубирования посевов. Тест с метиловым красным показывает степень закисления среды при расщеплении глюкозы. Метилрот как индикатор срабатывает в диапазоне рН 4,4...6,0. Исследуемую культуру выращивают 2...5 сут в жидкой среде Кларка с глюкозой. Затем на 5 мл среды добавляют пять-шесть капель раствора метилрота. Положительный результат — покраснение среды после внесения индикатора (рН 4,0...5,0).
Среда Кларка: пептон — 5 г, гидрофосфат калия — 5 г, глюкоза — 5 г, вода дистиллированная — 1000 мл. Ингредиенты растворяют в воде, кипятят 2...3мин, фильтруют через бумажный фильтр, устанавливают рН 6,9...7,0, разливают по пробиркам и стерилизуют при 112º С 20 мин.
Тест Фогес-Проскауера выявляет промежуточный продукт расщепления глюкозы — ацетоин (ацетилметилкар-бинол, диметилкетон). Исследуемую культуру выращивают на среде Кларка. К 1 мл культуры добавляют 0,6 мл 5%-го раствора а-нафтола, перемешивают, вносят 0,2 мл 40%-го раствора гидроксида калия и инкубируют 1 ч. Положительная реакция — красное окрашивание среды.
Выявление протеолитических и других ферментов микроорганизмов.Протеолитические ферменты расщепляют белки питательной среды до промежуточных (пептоны, полипептиды, аминокислоты) или конечных (сероводород, индол, аммиак) продуктов.
Характер роста микроорганизма на молоке: при посеве исследуемой культуры бактерий на стерильное обезжиренное молоко можно выявить фермент, расщепляющий молочный сахар (лактозу), и протеолитические ферменты, действующие на молочный белок (казеин). Расщепление лактозы приводит к закислению и свертыванию молока, при выделении протеолитических ферментов казеин постепенно растворяется — пептонизируется, в результате чего молоко просветляется, приобретает легкий кремовый оттенок, а на дне пробирки формируется осадок. Свертывание молока может также происходить под влиянием выделяемого некоторыми бактериями «сычужного» фермента, в этом случае реакция молока бывает щелочной. Иногда возможна пептонизация казеина без свертывания молока.
Тест на гидролиз казеина в плотных питательных средах: обезжиренное молоко диализуют для удаления лактозы, которая ингибирует гидролиз казеина. В расплавленный питательный агар с двойной концентрацией агар-агара добавляют равный объем стерилизованного автокла-вированием диализованного молока. Исследуемую культуру бактерий засевают «штрихом» на поверхность питательной среды, разлитой в чашки Петри. Посевы инкубируют до 14 сут. Перед учетом результатов поверхность среды заливают 10%-м раствором соляной кислоты. Положительный результат — просветление среды вокруг колоний.
Тест на желатиназу: культуру микроорганизма засевают уколом в столбик питательного бульона, содержащего 12 % желатины. После культивирования опытную и контрольную (незасеянную) пробирки охлаждают под холодной водой и по «текучести» желатины делают заключение о наличии фермента.
Тест на сероводород: узкие полоски фильтровальной бумаги смачивают в 5%-м растворе ацетата свинца, высушивают, стерилизуют. Культуру микроорганизма засевают в питательную среду в пробирке, после чего индикаторную бумагу помещают в пробирку (не должна касаться среды) и закрепляют пробкой. Выделяющийся сероводород реагирует с ацетатом свинца, и образующийся сульфид свинца вызывает почернение бумаги (положительный результат). Описанный метод выявления сероводорода при помощи индикаторных бумажек считают одним из наиболее чувствительных, разработаны и другие методы.
Тест на индол: исследуемую культуру целесообразно выращивать на средах, богатых триптофаном, при расщеплении которого образуется индол (бульон Хоттингера, бульон с 0,1% Z-триптофана). К выращенной культуре добавляют 1...3мл эфира, встряхивают, отстаивают и вносят 0,5 мл реактива Эрлиха (парадиметиламинобензоальдегид — 1 г, 96%-й этанол — 95 мл, соляная кислота —20 мл). Через 5 мин учитывают результат. Появление на границе эфира и питательной среды красно-фиолетового окрашивания свидетельствует о наличии индола.
Тест на аммиак: исследуемую культуру засевают в жидкую питательную среду в пробирке. Между пробкой и стенкой пробирки закрепляют полоску розовой лакмусовой индикаторной бумажки. Посевы инкубируют в термостате 1...5сут. Посинение лакмусовой бумажки свидетельствует о выделении аммиака.
Тест на уреазу: исследуемую культуру микроорганизма засевают на среду Кристенсена (пептон — 1 г, хлорид на трия — 5 г, дигидрофосфат калия — 2 г, агар — 20 г, глюкоза — 1 г, 0,2%-й раствор фенолрота — 6 мл, 20%-й раствор мочевины — 100 мл, вода дистиллированная — 1000 мл) и выращивают 1...4сут. Положительный результат — покраснение среды в результате ее защелачивания.
Тест на редукцию нитратов выявляет восстановление нитратов до нитритов. Культуру микроорганизма засевают в МПБ, содержащий 0,2 % нитрата калия, инкубируют 48...72 ч, затем в опытную и контрольную пробирки добавляют по 1 мл реактива с крахмалом (растворимый крахмал — 1 г, вода дистиллированная — 100 мл, йодид калия —0,5 г). К этому раствору перед постановкой реакции добавляют несколько капель 10%-го раствора соляной кислоты. Положительный результат— темно-синее окрашивание.
Тест на общую фосфатазу: исследуемую культуру микроорганизма засевают «штрихом» на поверхность питательного агара с натриевой солью .дифосфата фенолфталеина, инкубируют 4...5 сут. Чашки переворачивают вниз крышкой, на внутреннюю поверхность которой наносят каплю 28...30%-го раствора нашатырного спирта. При наличии фосфатазы колонии приобретают красный цвет.
Тест на каталазу: бактериальную массу снимают с поверхности агара бактериологической петлей и суспендируют в капле 3%-го раствора перекиси водорода на предметном стекле. Положительный результат — образование пузырьков газа.
Тест на оксидазу: фильтровальную бумагу пропитывают 1%-м раствором тетраметилпарафенилендиамина дигид-рохлорида. Бактериальную массу петлей наносят на поверхность бумажной полоски. Положительный результат — фиолетовое или пурпурное окрашивание через 10...60 с.
Тест на редуцирующую способность бактерий (в метиленовом молоке) основан на следующей особенности: при окислительно-восстановительных реакциях у бактерий акцептором водорода может быть кроме молекулярного кислорода ряд органических красителей, которые, присоединяя водород, восстанавливаются и обесцвечиваются. Такие свойства отмечены у лакмусовой настойки, метиленового синего, малахитового зеленого и т. д. Например, молоко с метиленовым синим готовят так: молоко подщелачивают 10%-м раствором карбоната натрия до рН 7,2 и добавляют 20 мл 1%-го водного раствора метиленового синего на 1000 мл. Готовая среда голубого цвета. Результат учитывают через сутки инкубирования посевов. В случае редукции красителя среда окрашена в кремовый цвет.
Тест-системы для быстрой идентификации бактерий по группе специально отобранных биохимических признаков обычно представляют собой пластмассовые пластины с лунками (микропробирками), заполненными различными сухими средами (субстратами). В эти среды вносят суспензию исследуемой культуры и после инкубирования учитывают результат. К тест-системам прилагают таблицы для учета результатов и идентификации микроорганизмов в зависимости от спектра выявленных ферментов.
За рубежом разработаны тест-системы для идентификации энтеробактерий, анаэробов, несбраживающих бактерий и т. д. В России Нижегородский институт микробиологии и эпидемиологии выпускает тест-систему подобного типа — биохимические пластины для идентификации энтеробактерий (ПБДЭ), кроме того, разработаны тест-системы для санитарно-микробиологи-ческих целей.
Принципы идентификации микроорганизмов. Основная задача бактериологического диагностического исследования — это определение таксономического положения выделенного микроорганизма путем сравнения его свойств со свойствами известных видов.
В рутинной бактериологической практике микроорганизм идентифицируют, изучая его фенотипические признаки (морфологические, тинкториальные, культуральные, биохимические, патогенные). Стали получать распространение некоторые методы идентификации по генотипическим признакам (см. тему 12), которые ранее в основном применяли в научной работе для классификации микроорганизмов с неясным таксономическим положением.
В бактериологии для идентификации используют определители микроорганизмов. Наиболее популярный — определитель бактерий Берджи — включает в себя описание свойств известных видов микроорганизмов. Бактерии в этом руководстве по ограниченному числу морфологических и физиологических признаков объединены в большие группы, например группа № 20 «Грамположительные неспорообразующие палочки неправильной формы» или группа № 5 «Факультативно-анаэробные грам-отрицательные палочки». В пределах этих групп при помощи нескольких дифференцирующих признаков бактерии подразделены на семейства, роды и виды. Распределение микроорганизмов в этом определителе не отражает иерархической классификации, а преследует сугубо практическую цель — как можно быстрее и экономичнее установить таксономическое положение изучаемого микроорганизма.
Идентификация неизвестного микроорганизма представляет собой процесс последовательного его отождествления с той или иной большой группой микробов, характеризующихся общими свойствами, затем с семейством в пределах группы, далее с тем или иным родом в пределах установленного семейства, и на конечном этапе исследуемый микроорганизм отождествляют (идентифицируют) по совокупности морфологических, тинкто либо видом в пределах рода. В случае необходимости внутри вида устанавливают принадлежность культуры к био-, серо-, фаговару. Работа с определителем Берджи предполагает использование достаточно большого количества тестов, характеризующих различные свойства микроорганизма. В практических диагностических лабораториях, исходя из эпизоотологических, клинических и патологоанатомических данных, обычно проводят бактериологические исследования, заранее ориентированные на обнаружение возбудителя определенной инфекционной болезни, по схеме, предусмотренной официальной инструкцией.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Ознакомиться с тестами, характеризующими ферментативные свойства бактерий (ферментация углеводов в средах Гисса, образование индола, сероводорода; тесты на каталазу, оксидазу, желатиназу и т. д.).
. 2. Используя карточки с описанием свойств бактериальной культуры, при помощи определителя микробов установить ее видовую принадлежность.
3. Оценить результаты изучения ферментативной активности двух бактериальных культур семейства Enterobacteriaceae на ПБДЭ-пластинах и определить их вид при помощи прилагаемой дифференциальной таблицы.
Контрольные вопросы
1.Какое таксономическое значение имеет определение набора ферментов у микроорганизмов?
2.Что представляют собой современные тест-системы для изучения ферментативной активности микроорганизмов?
3.Что такое определители бактерий?
Тема 10
БАКТЕРИОФАГИ
Цель занятия. Ознакомить студентов с действием бактериофагов и их практическим использованием.
Оборудование и материалы. Культура вакцинного штамма L. monocytogenes, набор листериозных бактериофагов, стерильный МПБ, содержащий 0,5 % глюкозы, 2%-й МПА в чашках Петри, стерильные пипетки Пастера, лечебно-профилактический бактериофаг против паратифа и колибактериоза телят, чувствительная к фагу культура Е. coli.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
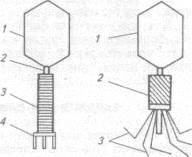
Бактериофаги представляют собой вирусы, адаптировавшиеся в процессе эволюции к паразитированию в прокариотических клетках (рис. 47). Репродукция многих бактериофагов в клетке приводит к ее лизису. На специфической адаптации фагов к строго определенным видам (штаммам) бактерий и внешнем проявлении поражения бактериальных клеток (лизис) основано практическое использование бактериофагов: при помощи известного (диагностического) фага можно обнаружить и идентифицировать бактерии. Кроме того, биологическая промышленность выпускает лечебно-профилактические бактериофаги.
Определение литической активности бактериофага. У диагностических и лечебно-профилактических фагов должна быть выражена литическая активность, которую определяют путем титрования фагов, например, в жидкой питательной среде.
В бактериологические пробирки разливают по 4,5 мл стерильного МПБ; в первую пробирку вносят 0,5 мл исследуемого фага, затем готовят его десятикратные разведения от 10~' до Ю-'0. К разведениям бактериофага добавляют по капле суточной бульонной культуры чувствительного к данному фагу вида бактерий, инкубируют при 37 °С 24 ч. За титр фага принимают его максимальное разведение, еще способное вызвать лизис бактерий — среда в пробирке прозрачна. Фаг считают активным при титре 10-7, 10-8
| Рис. 47. Схема строения фага Т2 по данным электронной микроскопии: а — с нуклеиновой кислотой в головке: 1 — головка; 2— полая центральная часть; 3 — оболочка (расправленная); 4— базальная пластинка; б —без нуклеиновой кислоты в головке: I — головка; 2 — оболочка (сокрашенная); 3 — хвостовые нити |
Определение количества бактериофага (по методу Грациа). Готовят десятикратные разведения исследуемого фага в физиологическом растворе (10-1…10-2 и т.д.), затем из последнего разведения, например 10-7 или 10-8, берут 0,5 мл жидкости, смешивают с равным объемом чувствительной к данному бактериофагу бульонной культуры бактерий. Полученную смесь добавляют к 4 мл расплавленного 0,7%-го МПА (температура 45 °С), перемешивают и выливают на поверхность подсушенного питательного агара в чашку Петри. Аналогичным образом поступают со всеми разведениями бактериофага (10-5, 10-5 и т.д.). Чашки инкубируют в термостате при 37 ºС 24 ч.
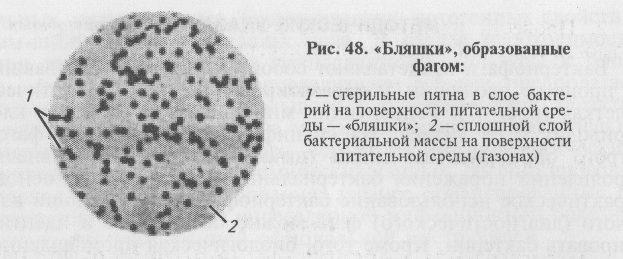
Учет результатов: не пораженные бактериофагом бактерии растут и образуют сплошной газон на поверхности питательного агара. Клетки, пораженные фагом, лизируются, и в этой зоне можно видеть «стерильные» пятна на сплошном бактериальном газоне. Количество этих пятен («бляшек») соответствует количеству фаговых частиц в суспензии (рис. 48).
Применение фагов для идентификации бактерий. Фаги применяют для видовой идентификации бактерий (возбудитель сибирской язвы, листериоза и др.) или внутривидовой — установление фаговара конкретного бактериального штамма.
Для идентификации неизвестной культуры бактерий при помощи диагностического бактериофага обычно используют плотную питательную среду. Например, исследуемую 18-часовую культуру, предположительно листерий, засевают в МПБ с глюкозой, инкубируют при 37 °С 4 ч до легкой опалесценции среды и затем засевают газоном (0,1мл) на подсушенный 2%-й МПА в чашку Петри. Через 1... 1,5 ч инкубирования посевов при 37 ºС при слегка приоткрытой крышке на одну половину газона наносят каплю листериозного бактериофага 2А и на вторую половину помещают каплю фага 4А. Посевы инкубируют при 22...25 °С 16...24ч.
Учет результатов: если культура листериозная, то на месте нанесения хотя бы одного фага можно видеть прозрачную зону лизиса.
Для установления фаговара исследуемую культуру проверяют с набором типовых фагов, охватывающих все фаговарианты данного вида бактерий, определяют, к какому фагу чувствителен данный штамм, что и служит его маркером.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Определить активность лечебно-профилактического коли-па-ратифозного фага по отношению к исследуемой культуре Е. coli.
2. Провести идентификацию культуры L. monocytogenes при помощи листериозных диагностических фагов.
Контрольные вопросы
1.Что такое бактериофаг?
2.Как используют бактериофаги?
3.Какими методами титруют бактериофаги?
Тема 11
Дата добавления: 2016-07-22; просмотров: 5124;











