Лекция №11: Водородный показатель кислотности и щелочности водных растворов. Ионное произведение воды. Растворимость.
Для выражения кислотности или щелочности раствора используют величину водородного показателя (рН), равную десятичному логарифму концентрации ионов водорода [H+], взятому с обратным знаком: рН=-lg[H+], где [H+]=[моль/л].
Таким образом, по характеру среду растворы можно подразделить на кислые (растворы, в которых концентрация ионов водорода больше концентрации гидроксид-ионов), щелочные (растворы, в которых концентрация ионов водорода меньше концентрации гидроксид-ионов) и нейтральные (растворы, в которых концентрация ионов водорода равна концентрации гидроксид-ионов).
| Характер среды (раствора) | Величина рН | Концентрация [Н+], моль/л |
| кислая | <7 | >10-7 |
| нейтральная | ~7 | ~10-7 |
| щелочная | >7 | <10-7 |
Существуют различные методы измерения рН. Приближенно реакцию среды возможно определить при помощи специальных реактивов, или индикаторов, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространёнными индикаторами являются: метиловый оранжевый, метиловый красный, фенолфталеин. В следующих таблицах даны характеристики основных применяемых индикаторов:
Таблица 1. Кислотно-основные индикаторы.
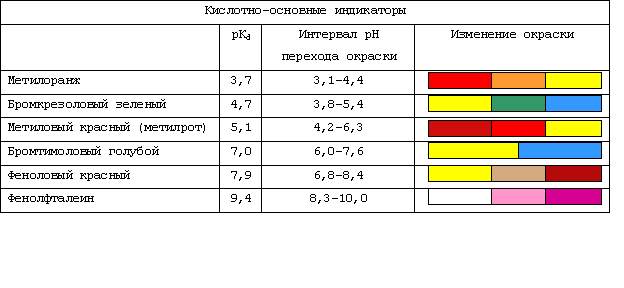 Таблица 2. Важнейшие индикаторы
Таблица 2. Важнейшие индикаторы
| Название индикатора | Цвет индикатора в различных средах | ||
| в кислой | в нейтральной | в щелочной | |
| Метиловый оранжевый | красный (рН<3,1) | оранжевый (3,1<рН<4,4) | желтый (рН>4,4) |
| Метиловый красный | красный (рН<4,2) | оранжевый (4,2<рН<6,3) | желтый (рН>6,3) |
| Фенолфталеин | бесцветный (рН<8,0) | бледно-малиновый (8,0<рН<9,8) | малиновый (рН>9,8) |
| Лакмус | красный (рН<5,0) | оранжевый (5,0<рН<8,0) | желтый (рН>8,0) |
Для воды и разбавленных водных растворов при Т=const:
[Н+]·[ОН-]=const=KH2O, где KH2O – ионное произведение воды.
При Т=298К (25°С) для чистой воды [Н+]=[ОН-]=10-7 моль/л, поэтому:
KH2O=10-7·10-7=10-14 или р[Н+]+р[ОН-]=14, т.е. р[Н+]=14-р[ОН-].
Т.о. сумма водородного и гидроксильного показателей в водных растворах при 25°С равна 14.
При увеличении температуры значение ионного произведения воды возрастает (например, при 100°С оно достигает величины 5,5·10-13).
Однако следует учитывать, что каковой бы ни была величина реакции раствора (рН), произведение концентраций [Н+]·[ОН-] остаётся неизменным. Величина ионного произведения воды может измениться только при изменении температуры, но не при увеличении [Н+] или [ОН-].
Дата добавления: 2020-10-14; просмотров: 860;











