Зеркальные изомеры аминокислоты аланина.
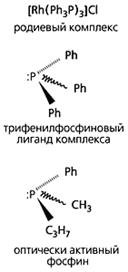 Структурные элементы, из которых У.Ноулс синтезировал катализатор для асимметричного гидрирования
Структурные элементы, из которых У.Ноулс синтезировал катализатор для асимметричного гидрирования
| Однако осуществить такой синтез весьма не просто, поскольку в ходе его с равной вероятностью образуются обе формы. Эту трудность успешно преодолел Ноулс. В 1968 г. он обнаружил, что можно получать требуемый изомер, если использовать для синтеза оптически активный катализатор. Когда Хорнер и Мислоу заменили в трифенилфосфине одну фенильную группу на метильный остаток, а другую на этильный, они получили оптический изомер фосфина. После этого Ноулс и предположил, что, заменив трифенилфосфиновую группу в металлокомплексе Уилкинсона на энантиомер Хорнера и Мислоу, можно получить зеркально-симметричные формы катализатора, который в реакциях гидрирования будет превращать оптически неактивный реагент (субстрат) в лево- или правовращающий продукт реакции. |
Эксперименты Ноулса по катализу асимметричного гидрирования оказались успешными и открыли новое поле исследований как в академической науке, так и в промышленном синтезе. Индустриальное получение аминокислоты L-ДОФА (диоксифенилаланина), которую начали применять для лечения паркинсонизма, тоже плод достижений Ноулса. Вместе с коллегами он перебрал энантиомеры фосфинов разной структуры, прежде чем создать нужный катализатор, а получив его, быстро достиг желаемого результата. В “Monsanto Company”, где работал Ноулс, по его способу стали синтезировать L-ДОФА в промышленных масштабах, причем выход конечного продукта достигал 97.5 %.
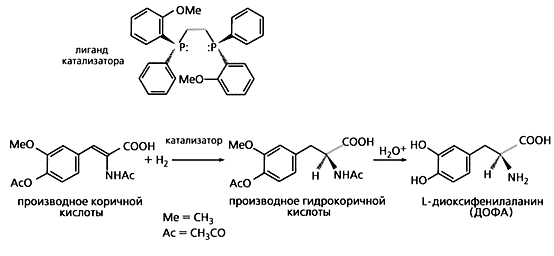
Схема реакции, по которой получают левовращающий изомер диоксифенилаланина (ДОФА),
применяемого для лечения паркинсонизма.
Дальнейшая разработка каталитического асимметричного синтеза принадлежит японскому химику Р.Нойори. К 1980 г. он уже создал оба стереоизомера катализатора, в котором родий связан уже с другим лигандом - динафтилдифенилфосфином. C той поры можно было получать нужный энантиомер требуемой аминокислоты с выходом, приближающимся к 100%. Этот же лиганд с начала 80-х годов используется компанией “Takasago International” для промышленного синтеза ментола.
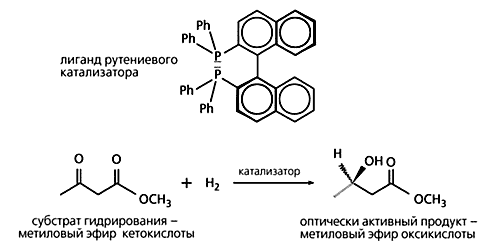
Схема стереоселективного восстановления кетона.
С помощью разработанного катализатора, в который Нойори включил рутений и оптически активный лиганд динафтилдифенилфосфин, эфир кетокислоты восстанавливается до эфира оксикислоты, а выход требуемого энантиомера составляет 99.5%
Однако Нойори видел необходимость конструирования катализатора, который был бы пригоден для гидрирования более широкого круга соединений. Добиться этого ему удалось, когда переходный металл родий был заменен на рутений. Созданный катализатор обеспечивал присоединение атома водорода по месту разрыва двойной связи в органических соединениях разных классов и вполне годился для промышленного синтеза энантиомеров многих веществ. Так была впервые получена R-форма двухатомного спирта 1,2-пропандиола (1,2-пропиленгликоля), который необходим для индустриального синтеза антибиотика левофлоксацина. За счет подобных реакций в фармацевтической промышленности начали производить и другие антибиотики. Катализаторы Нойори нашли применение в синтезе оптически чистых химических веществ, лекарственных препаратов и неизвестных до его открытий материалов.
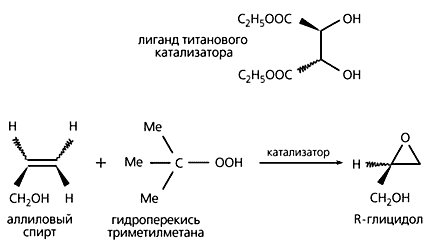
Бок о бок с работами по каталитическому синтезу энантиомеров в реакциях гидрирования шли исследования Б.Шарплесса, который занимался созданием оптически активного катализатора для реакций другого типа - окислительных. И такой катализатор - комплексное соединение, содержащее титан в качестве переходного металла и оптический изомер диэтилового эфира винной кислоты в качестве лиганда, - был синтезирован. В 1980 г. Шарплесс провел серию успешных экспериментов, приведших его к практическому воплощению каталитического окисления оптически неактивного аллилового спирта до R-изомера глицидола с выходом 95%.
Дата добавления: 2016-05-30; просмотров: 2498;











