Родерик Мак-Киннон (RoderickMacKinnon),
родился в 1956 г., вырос в Берлингтоне,
пригороде Бостона (шт. Массачусетс). Окончил
Университет Брендиса в Бостоне, в 1982 г. стал
доктором медицины в бостонской Медицинской
школе Тафтса. С 1996 г. - профессор молекулярной
нейробиологии и биофизики в Рокфеллеровском
университете (Нью-Йорк).
От структуры любого соединения зависят, как известно, его свойства, а в живом организме - и функции. Именно структурные исследования и послужили основой для понимания работы ионных каналов в клеточной мембране, образованных белковыми молекулами (или их комплексами), которые пронизывают ее насквозь. Работой канальных белков обеспечивается клеточный обмен веществами, в том числе неорганическими катионами (в основном K+, Na+ и Ca2+) и анионами (главным образом Cl-), причем почти для каждого вида ионов имеются свои собственные каналы. Благодаря передвижению ионов через мембрану на ней возникает разность потенциалов, генерируются электрические токи, без которых невозможна жизнь клетки, на передаче электрических сигналов основана работа мозга, важнейшего органа животных.
Р. Мак-Киннон и его коллеги расшифровали структуры и механизм функционирования нескольких бактериальных белков, каждый из которых формирует канал, проводящий ионы калия в ответ на изменение мембранного потенциала. Для этого понадобилось использовать биохимические методы, мутагенез, клонирование белкового гена, экспрессию белка, получать моноклональные антитела, изучать влияние ингибиторов в электрофизиологических опытах.
Из физических методов исследования применялась масс-спектрометрия, непосредственно структура белка была установлена рентгенокристаллографически и на ее основе построены стереомодели с помощью компьютера. Проделана поистине гигантская работа, и получены впечатляющие результаты: определены положение каждого структурного элемента в общей конструкции канала и механизм, который обеспечивает избирательность катионной проводимости и чувствительность к изменению потенциала на мембране.
Любой ионный канал, или пора, имеет узкий селективный фильтр и ворота, причем образованы они разными структурными элементами белка. Ворота могут открываться и закрываться в ответ на изменение мембранного потенциала, концентрации иона, механическое воздействие, связывание с определенной сигнальной молекулой и т.д.
Катионные каналы (калиевые, натриевые и кальциевые), зависящие от потенциала на мембране и образующие большое семейство, построены по одному принципу. Самым подробным образом он представлен Мак-Кинноном на примере канального белка KvAP, выделенного из архебактерии Aeropyrum pernix. Его четыре одинаковые молекулы (субъединицы) окружают центральную проводящую ионы пору, стенки которой “облицованы” двумя гидрофобными спиральными сегментами - S5 и S6 - каждой субъединицы. Таких сегментов-спиралей, гибко соединенных между собой петлями, шесть. Вместе они составляют два разных функциональных участка - селективный фильтр (S5 и S6), определяющий ионную избирательность, и сенсор (S1-S4), реагирующий на изменение потенциала (рис.1). В этом структурном элементе особенно важны первые четыре остатка аргинина, несущие положительные заряды. За счет гибкости сочленения спиралей вся конструкция способна менять конформацию, чем обеспечивается закрытое или открытое состояние ворот и быстрый, избирательный перенос катионов.
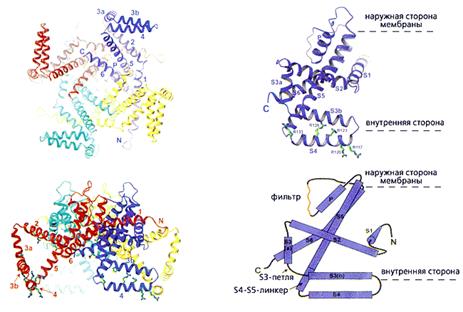
Рис. 1. Стереомодель полного KvAP канала и одной субъединицы. Тетрамер изображен с внутренней стороны мембраны (1) и повернутым на 90° относительно горизонтальной оси (2); каждая субъединица показана своим цветом. Одна из них представлена отдельно (3) и дана также в виде схемы (4), чтобы были отчетливее видны топология спиральных сегментов (S1-S6), соединяющих петель (S3-петли, S4-S5-линкера), поры (Р) и фильтра. Здесь же приведены остатки аргинина (R117, 120, 123, 126, 133), четыре из которых находятся в “лопасти” сенсора. Буквами C и N обозначены карбоксильный и аминный концы полипептидной цепи
Карбонильные атомы кислорода шести следующих друг за другом аминокислот (треонина, валина, глицина, тирозина и глицина), находящихся в узком селективном фильтре, направлены к его просвету, благодаря чему они координируют ионы калия. Боковые же цепи валина и тирозина - “смотрят” внутрь гидрофобной сердцевины, и тем стабилизируют основную цепь проводящей поры.
Сегмент S6 способен отклоняться от оси центральной поры за счет глицина, посредством которого сочленяется со спиралью S5. Соединенный с ней напрямую датчик потенциала во время работы канала оттягивает ее от оси поры, а следом отклоняется и спираль S6. Таким образом, они движутся вместе, как единое целое.
Мак-Киннон, начавший “канальную” карьеру в 30 лет, за истекшие годы преуспел в расшифровке и других молекулярных машин. Он занимается изучением еще нескольких каналов: калиевых, регулируемых ионами кальция; чувствительных к механическому воздействию, и тех, что избирательно пропускают ионы хлора. Проводятся также рентгено- и электронокристаллографические исследования, чтобы получить модель ацетилхолинового рецептора с более высоким, чем прежде, разрешением. Работа по выяснению механизмов действия отдельных молекул продолжается.

Питер Эгр (Peter Agre) родился в 1949 г. в
Нордфилде (шт. Миннесота). В 1970 г. окончил
колледж при Миннесотском университете в
Миннеаполисе, где специализировался по химии. В
1974 г. получил степень доктора медицины в
медицинской школе при Университете Джона
Хопкинса в Балтиморе (шт. Мэриленд), с 1993 г.
занимает там должность профессора биологической
химии и профессора медицины.
Почти из 50 видов каналов, обнаруженных в мембране к середине 80-х годов, не было известно ни одного проводящего воду. Между тем клеточная мембрана, лишь ограниченно проницаемая для молекул воды, пропускает ее в цитоплазму эритроцитов, почечных проксимальных канальцев и некоторых других тканей с чрезвычайно высокой скоростью. Этот феномен можно было бы объяснить наличием специальных пор. Их многие искали, но безуспешно. Эгру посчастливилось первому. В 1988 г. вместе с коллегами он выделил (из эритроцитов и почечных проксимальных канальцев) и частично охарактеризовал неуловимый, встроенный в мембрану белок неизвестной функции. Как позже выяснилось, четыре его молекулы и образуют пору, по которой проникает вода.
Через три года П.Эгр и Дж.Престон получили кодирующую этот белок ДНК, чтобы в последующем “наработать” его, экспрессируя ген в ооцитах шпорцевой лягушки. Белок-канал, названный аквапорином-1 (AQP1), как теперь известно, входит в состав обширного семейства: подобные ему участвуют во множестве физиологических процессов всех живых клеток – и растительных, и животных.
Установив структуру аквапорина-1 рентгенокристаллографическим методом, Эгр определил длину и положение всех спиральных фрагментов и соединяющих их петель, угол, под которым соседние спирали отклоняются друг от друга; нашел места, где участки полипептидной цепи пересекают мембрану; выяснил роль консервативных в белках аквапоринового семейства аминокислотных остатков и влияние их отдельных боковых групп на стабильность и работу канала. В результате теперь мы в деталях знаем, как выглядит канал, пропускающий воду.
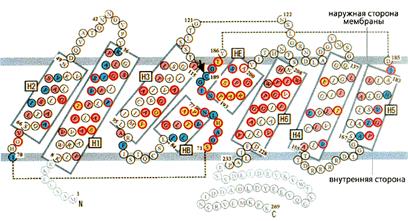
Рис. 2. Схема расположения фрагментов, составляющих мономер аквапорина
Построен он из четырех молекул аквапорина-1 (каждая состоит из 269 аминокислотных остатков), которые образуют два повтора из трех a-спиральных участков (рис.2). Именно эти шесть спиралей и выстилают стенки проводящей поры и обусловливают ее гидрофобность. Небольшие же петли - цитоплазматическая (В) и внеклеточная (Е), - соединяющие повторы, обеспечивают строгую избирательность. N- и С-концевые фрагменты мономера закреплены во внутреннем слое мембраны и выходят в цитоплазму. В тетрамере каждая субъединица точно подогнана к двум соседним и связана с ними α-спиралями, которые выходят за пределы мембраны либо с внешней, либо с внутренней стороны. Функциональные петли В и Е расположены посередине между мембранными слоями, и в этом месте канал сужается (рис.3). Диаметр поры здесь составляет около 3 A, т.е. чуть больше диаметра молекулы воды (2.8 A). Ясно, что через столь малую щель не могут проникнуть крупные молекулы каких-либо растворимых веществ. Но через нее не проходят и протоны. Почему? Эгр это выяснил.
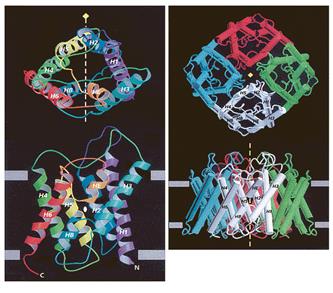
Рис. 3. Стереомодель субъединицы аквапорина и структура тетрамера, показанные с внеклеточной стороны и сбоку (вверху). Спирали в полном белке изображены в виде цилиндров
В полипептидной цепочке каждой функциональной петли содержится фрагмент из следующих друг за другом аспарагина, пролина и аланина (Асн-Про-Ала). Положение петель в поре стабилизировано образованием ионных пар и водородных связей с определенными аминокислотными остатками в структурных спиралях. За счет ван-дер-ваальсовых взаимодействий между пролинами 77 и 193 петли В и Е удерживаются в тесном соседстве. Гидрофобность внутренней поверхности поры и узость щели оказались очень важными для обеспечения исключительно высокой скорости проведения воды.
Архитектура канала такова (узкая щель в центре и расширения на противоположных концах), что вода может проникать только в виде тонкой цепочки молекул, соединенных водородными связями. Было известно, что в грамицидиновом канале такая цепочка с большой эффективностью захватывает протоны. Но так как через аквапориновую пору они не просачиваются, это должен обеспечивать специальный механизм.
Долгое время он оставался неизвестным в структурной биологии аквапорина. Считалось, что блокировка требует разрыва водородных связей в водной цепочке и образования новых, но уже с какими-то структурными элементами на поверхности поры. Эгр выяснил, что такой разрыв действительно включен в этот процесс и главная роль в нем принадлежит функциональным спиралям НВ и НЕ.
Поскольку дипольные моменты спиралей генерируют положительное электростатическое поле, атомы кислорода в молекуле воды, подошедшей в виде цепочки к центру мембранного пространства, ориентируются к участку Асн-Про-Ала (рис.4). В результате между кислородом и амидной (NH-) группой аспарагина образуется водородная связь, а в цепочке - разрыв. Так возникает препятствие на пути протона.

Рис. 4. Механизм, предотвращающий проведение протонов через водную пору. Благодаря диполям спиралей атомы кислорода в молекулах воды, оказавшихся в сужении поры, ориентируются к боковым группам аспарагинов 76 и 192 (вверху). После этого между их амидными группами и кислородом образуются водородные связи, а те, что соединяли непрерывную цепочку молекул воды, в этом месте обрываются
Открытые Эгром аквапорины - биохимический фундамент для очень важной области физиологии и медицины. Подобные белки, способные проводить 3·109 молекул воды в секунду в расчете на каждый мономер, есть во всех без исключения живых клетках. У арабидопсиса содержится не меньше 35 вариантов этих белков, а у человека - 11, причем многие могут быть связаны с разными заболеваниями. Физиологическая роль аквапоринов особенно бросается в глаза в почках, через которые в сутки проходит от 150 до 200 л воды.
Мембранные каналы лежат в основе клеточных функций, таких как межнейронная сигнализация, мускульное сокращение, поглощение воды почками, всасывание корнями растений, поддержание осмотического давления у микроорганизмов.
Нобелевские лауреаты - Р.Мак-Киннон и П.Эгр - не только установили структуры канальных белков, но и показали изящные молекулярные машины в действии.
Дата добавления: 2016-05-30; просмотров: 1390;











