Сворачивания полипептидной цепи в нативную конформацию
В середине 80-х годов началась новая эра в исследовании механизмов регуляции сворачивания белков in vivo. Было обнаружено, что в клетке существует особая категория белков, основной функцией которых является обеспечение правильного характера сворачивания полипептидных цепей в нативную структуру. Эти белки, связываясь с развернутой или частично развернутой конформацией полипептидной цепи, не дают ей «запутаться», образовать неправильные структуры. Они удерживают частично развернутый белок, способствуют его переносу в разные субклеточные образования, а также создают условия для его эффективного сворачивания. Эти белки получили название «молекулярные шапероны», образно отражающее их функцию (английское слово chaperone близко по смыслу к слову «гувернантка»).
К настоящему времени описано несколько классов шаперонов, различающихся по структуре и специфическим функциям. Все шапероны являются так называемыми «белками теплового шока», синтез которых резко увеличивается в стрессовых для клетки ситуациях. Поэтому сокращенное название этих белков – hsp (heat shock proteins). Однако и в нормальных условиях каждая клетка содержит определенный набор шаперонов, необходимых для ее жизнедеятельности. Классификация шаперонов основана на величине молекулярной массы составляющих их полипептидных цепей (субъединиц), которая варьирует от 10 кДа (для белка hsp10) до 90 кДа (для белка hsp90) и выше. По характеру выполняемых этими белками функций их можно разделить на два больших семейства – шапероны, или hsp70, и шаперонины, к которым относятся hsp60 и hsp10.
Роль шаперонов заключается в том, что они удерживают белки в развернутом состоянии. Кроме этого, в клетках эукариот шапероны выполняют также важную роль в транспорте белков через мембраны митохондрий, хлоропластов и эндоплазматического ретикулума. Роль шаперонинов состоит в том, что они обеспечивают эффективное сворачивание белков.
В отличие от довольно просто построенных шаперонов (состоящих из одной-двух полипептидных цепей – субъединиц), шаперонины представляют собой сложные олигомерные структуры (рис. 1.3.3.).
Наиболее изученные hsp60 митоходрий, а также клеток E. coli, построены из 14 субъединиц, организованных в два семичленных кольца, лежащих одно под другим. В центре построенного таким образом цилиндра имеется полость – канал (диаметром 45 ангстрем), в котором и происходит сворачивание полипептидной цепи, перешедшей на шаперонин с шаперона hsp70. На рисунке также показана структура hsp10, маленького белка, также образующего олигомерную структуру – кольцо из семи субъединиц, способное, как «шапочка», прикрывать вход в канал молекулы шаперонина после того, как туда попадает полипептидная цепь. Проникновение полипептидной цепи в центральный канал молекеулы hsp60, сопровождающееся присодинением hsp10 и закрыванием входа в канал также показано на рисунке.
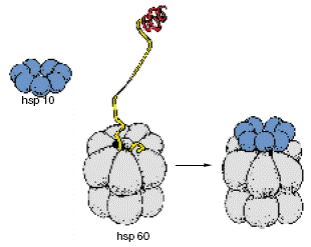
Рис. 1.3.3. Структура шаперонина hsp60 и его кофактора – hsp10
Дата добавления: 2020-10-01; просмотров: 690;











