Общая характеристика
Аминокислоты – это производные углеводородов, в молекуле которых содержатся карбоксильные –COOH и амино – NH2 – группы.
Аминокислоты можно рассматривать как производные кислот, в радикале которых атом водорода замещён на аминогруппу.
При использовании тривиальных названий положение аминогруппы по отношению к карбоксилу обозначают буквами греческого алфавита:

По заместительной номенклатуре ИЮПАК аминокислоты называют по соответствующей карбоновой кислоте с добавлением префикса амино-, а положение аминогруппы указывают соответствующей цифрой:
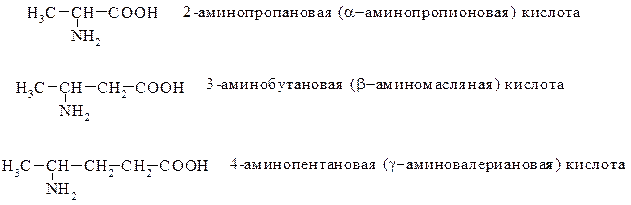
Все же для аминокислот наиболее употребительными являются названия, которыми пользуются в биохимии и которые приняты номенклатурной комиссией ИЮПАК.
Так, простейшая аминокислота, образованная от уксусной кислоты H2N–CH2–СООН, называется глицином или гликоколом; аминокислота на основе пропионовой кислоты, содержащей аминогруппу у С2 — аланином и т.д.
В литературе при описании последовательности соединения a-аминокислот в пептидах и белках используют сокращенные трехбуквенные обозначения, общепринятые в литературе.
С биологической точки зрения наибольшее значение имеют
α-аминокислоты, являющиеся структурными компонентами белков, участвующих во всех процессах жизнедеятельности живого организма. Из множества известных природных аминокислот лишь 20 участвуют в построении практически всех белков. Наиболее характерной особенностью этих аминокислот является то, что обе функциональные группы связаны с одним и тем же углеродным атомом, который является асимметрическим. Исключение составляет глицин.

Таким образом, все аминокислоты, участвующие в построении пептидов и белков, являются оптически активными a-аминокислотами (за исключением глицина).
Все a-аминокислоты, входящие в состав пептидов и белков животного происхождения, имеют S-конфигурацию хирального центра (за исключением цистеина) и относятся к L-стереохимическому ряду.
Аминокислоты D-стереохимического ряда в природе встречаются редко, например, в некоторых пептидных антибиотиках (грамицидин).
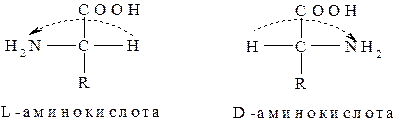
Из приведенных выше структур аминокислот следует, что простейшей из них является глицин (аминоуксусная кислота), которую можно считать за родоначальное соединение. Если один атом водорода ( на схеме он обведен пунктирной рамкой) заместить на радикал, то получится ряд аминокислот, отличающихся по природе радикала и, следовательно, физическими свойствами. В зависимости от природы радикала a-аминокислоты делятся на: нейтральные (глицин, аланин, валин, лейцин, изолейцин); кислые (аспарагиновая кислота, глутаминовая кислота); основные (аргинин, лизин); амиды (аспарагин, глутамин); гидроксилсодержащие (серин, треонин); серасодержащие (цистеин, метионин); ароматические (фенилаланин, тирозин) и гетероциклические (триптофан, гитсидин, пролин).
Способы получения
a-Аминокислоты. Производство a-аминокислот с каждым годом расширяется в связи с ростом потребности, поскольку их стали широко использовать в медицинской практике в качестве лекарственных препаратов, для парентерального применения, в качестве добавок в продукты питания, в косметологии, а также в качестве исходных веществ для пептидного синтеза.
Из белковых гидролизатов различными способами удается получать индивидуальные оптически активные a-аминокислоты.
Синтетическими методами, как правило, получают рацемические смеси.
Действием аммиака на a-галогенкарбоновые кислоты (реакция аммонолиза):

Во избежание побочных реакций (образование вторичных и третичных аминопроизводных) следует применять десятикратный избыток концентрированного раствора аммиака.
Необходимо отметить, что этот метод применим для получения кислот с любым удалением аминогруппы. Однако более доступными являются a-галогенкарбоновые кислоты. Все же удобным способом амминирования галогенкарбоновых кислот является взаимодействие их эфиров с фталимидом калия (реакция Габриэля):
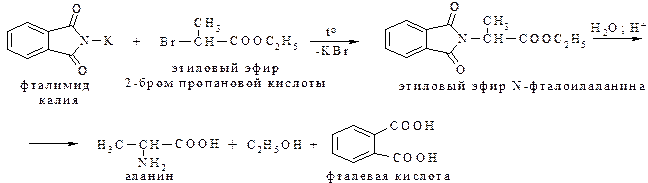
Модификацией реакции фталимидного синтеза является использование диэтиловго эфира броммалоновой кислоты вместо эфира a-галогенмонокарбоновой кислоты.
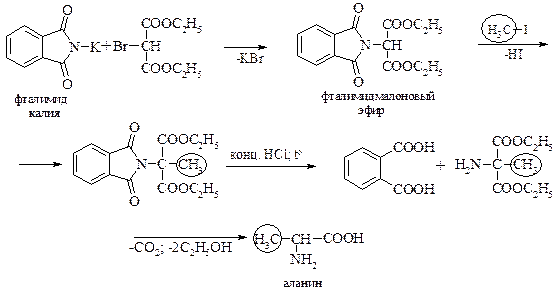
Циангидринным методом. Исходный альдегид или кетон взаимодействует с водным раствором, содержащим цианид калия и хлорид аммония, которые взаимодействуют между собой:
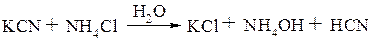
Далее циановодород взаимодействует с альдегидом или кетоном с образованием промежуточного циангидрина, в котором гидроксигруппа замещается в условиях реакции на аминогруппу, а затем полученный аминонитрил гидролизуется до соответствующей a-аминокислоты:
 Восстановлением оксимов или гидразонов a-оксокислот:
Восстановлением оксимов или гидразонов a-оксокислот:

Дата добавления: 2020-10-01; просмотров: 614;











