Химические свойства
В карбоксильной группе атом углерода находится в состоянии sp2-гибридизации и он связан двойной связью с атомом кислорода, а простой связью с гидроксигруппой и с водородом (муравьиная кислота) или углеводородным радикалом (остальные кислоты).
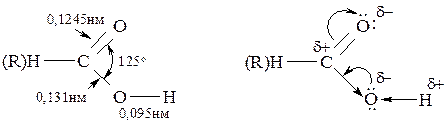
В карбоновых кислотах длина связи С=О больше, чем в кетонах, а связь С–ОН короче, чем в спиртах. Это свидетельствует о взаимодействии электронных пар атома кислорода ОН-группы и С=О за счёт мезомерного и индуктивного эффектов. С одной стороны это приводит к увеличению полярности связи Н–О, но с другой стороны способствует уменьшению положительного заряда на атоме углерода по сравнению с альдегидами и кетонами.
Таким образом, за счёт указанных электронных эффектов в карбоксильной группе формируются два электрофильных центра – водород гидроксигруппы и атом углерода. Атомы кислорода являются нуклеофильными центрами. Понижение электронной плотности на карбоксильном углероде приводит к смещению электронного облака от α-углеродного атома к карбоксилу.
Высокая полярность и лёгкая поляризуемость связи Н–О способствуют отрыву протона и образованию карбоксилат-аниона. Исходя из особенностей электронного строения карбоксильной группы, можно говорить о многосторонней реакционной способности карбоновых кислот, обусловленной: лёгкостью отрыва протона (ОН-кислотность); наличием нуклеофильных центров; наличием электрофильного центра; СН-кислотным центром в α-положении.
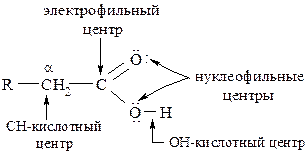
Кислотность
Карбоновые кислоты в водных растворах диссоциированны, что доказывается индикаторами. Они являются более сильными кислотами, чем спирты и фенолы, что объясняется делокализацией отрицательного заряда в образующемся карбоксилат-анионе:
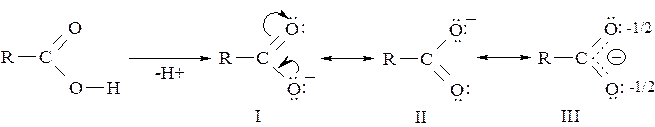
В структуре III длина обеих связей С–О одинаковая и составляет примерно 0,127нм, что является средней между С=О связью (0,1245нм) и С–ОН (0,131нм).
Степень диссоциации карбоновых кислот зависит от различных факторов:
наибольшая степень диссоциации характерна для водных растворов;
в апротонных неполярных растворителях карбоновые кислоты практически недиссоциированы;
наличие электроноакцепторных заместителей в α-положении увеличивает кислотность (сравните для СН3СООН рКα = 4,76, а для Cl3C–COOH рКα = 0,64).
Карбоновые кислоты значительно сильнее угольной и вытесняют её из соответствующих солей:
2СН3СООН + Na2CO3 → 2CH3COONa + H2O + CO2
Они образуют соли под действием алкоголятов:
CH3COOH + C2H5ONa → CH3COONa + C2H5OH
Как протонные кислоты, взаимодействуют с активными металлами, их оксидами и гидроксидами, а также аммиаком с образованием солей:
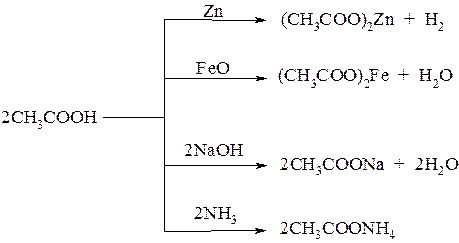
Дата добавления: 2020-10-01; просмотров: 614;











