Химические свойства
Высокая полярность связи Csp3–Hal является результатом перераспределения электронной плотности, в связи с чем в молекуле формируется электрофильный центр. Таковым становится атом углерода, непосредственно связанный с галогеном. Результатом отрицательного индуктивного эффекта, проявляемого галогеном (-I–эффект), является полярность молекулы. Следует также учитывать, что связь C–Hal характеризуется высокой поляризуемостью, т.е. становится ещё более полярной под воздействием реакционной среды.
Поляризуемость связи C–Hal увеличивается от C–F к C–I, что и подтверждается в реакциях нуклеофильного замещения.
Подвижность атома галогена в аллильном положении гораздо выше. Это объясняется тем, что образующийся при диссоциации аллильный катион стабилизируется за счёт сопряжения свободной р-орбитали катионного атома углерода с соседней π-связью, что способствует делокализации положительного заряда:
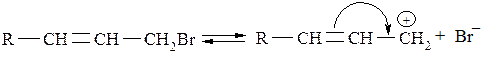
В предельных галогенопроизводных вследствие индуктивного эффекта формируется ещё один реакционный центр – СН-кислотный центр с участием β-углеродного атома.
Галогенопроизводные Сsp3–Hal характеризуются высокой реакционной способностью. Для них наиболее характерны реакции нуклеофильного замещения, при которых галоген замещается на нуклеофил, а также реакции β-элиминирования, в которой участвует СН-кислотный центр (β-углеродный атом).
11.3.1. Реакции нуклеофильного замещения у галогенопроизводных типа Csp3–Hal
Высокая полярность и поляризуемость связи C–Hal являются причиной лёгкого разрыва этой связи по гетеролитическому механизму при нуклеофильной атаке молекулы:

Данная реакция представляет собой пример типичного нуклеофильного замещения по SN2-механизму:
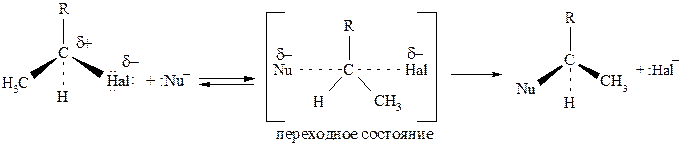
Важно отметить, что если в исходной молекуле α-углеродный атом является асимметрическим, то в результате SN2-реакции происходит изменение конфигурации: S-конфигурация переходит в R и наоборот. Таким образом реакция по SN2 мехпнизму является стереоспецифической.
Из схемы реакции видно, что уходящей частицей является галогенид-анион, который представляет собой слабое основание: чем слабее выражены основные свойства галогенид-аниона, тем он более стабилен и тем легче происходит замещение.
В ряду галогенид-анионов наиболее слабым основанием и, следовательно, самой легко уходящей частицей является I-, затем Br-, Cl- и F-.
При переходе от первичных галогенопроизводных к третичным, реакция нуклеофильного замещения протекает по SN1-механизму (см. разд. 11.1).
В качестве нуклеофилов могут быть использованы анионные нуклеофилы - ОН-; О- Alk-; CN-; нейтральные нуклеофилы – Н2О; NH3; NH2R; NHRR1; NR1R2R3; спирты, тиолы.
Используя перечисленные нуклеофилы, можно на основе галогенопроизводных получить соединения, относящиеся к разным классам.
Говоря о нуклеофилах, следует учитывать, что они являются основаниями по Брёнстеду и Льюису, хотя при этом необходимо помнить разницу в понятиях «основность» и «нуклеофильность».
Под основностью подразумевают реакционную способность основания, т.е. способность предоставлять электронную пару протону, который является кислотой.
Нуклеофильность – это способность предоставлять электронную пару карбкатиону, или другой положительно заряженной частице (кроме Н+).
Таким образом, основность – это понятие, относящееся к кислотно-основному взаимодействию, а нуклеофильность – это понятие, подразумевающее влияние основания Льюиса на реакции нуклеофильного замещения.
Гидролиз. Под действием свежеприготовленного гидроксида серебра или водного раствора щёлочи образуются спирты:
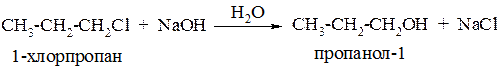
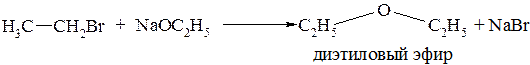
Образование простых эфиров. При взаимодействии с алкоголятами щелочных металлов можно получить простые эфиры:
Получение сложных эфиров. В этом случае используют соли карбоновых кислот и соответствующий галогеналкан. Более эффективно процесс протекает при использовании первичных или вторичных бром- или йодалканов:
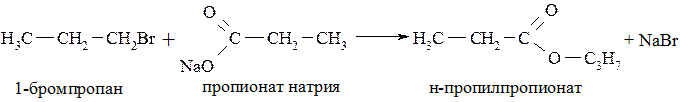
Дата добавления: 2020-10-01; просмотров: 743;











