Присоединение галогенводорода. Правило Марковникова
Галогенводороды следует рассматривать как H-электрофилы. В общем виде взаимодействие можно представить в виде последующих стадий:

Если в реакции гидрогалогенирования участвует несимметричный алкен, то направление присоединения в большинстве случаев предопределяется строением углеводорода. Данный процесс подробно исследовал В.В. Марковников и установил, что водород от галогенводорода присоединяется к наиболее гидрогенизированному (связанному с большим числом атомов водорода) при двойной связи атому углерода:
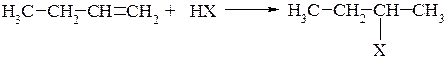
Объясняя правило Марковникова, следует учитывать такие факторы, как статический и динамический индуктивные эффекты.
В исходном алкене под влиянием алкильных групп происходит поляризация p-связи, вследствие чего на метиленовой группе – CH2 – формируется некоторый избыток отрицательного заряда, что в значительной степени определяет направление присоединения протона.
Следует отметить, что на третьей, последней стадии реакции нуклеофил (галогенид-анион) атакует как карбкатион, так и находящийся с ним в равновесии протониевый ион. Циклический протониевый ион, подвергаясь атаке нуклеофила (галогенид-аниона), может образовать два промежуточных карбкатиона:
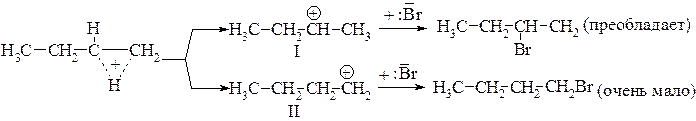 Образование карбкатиона является стадией, лимитирующей кинетику реакции. В процессе вовлечения протониевого иона в реакцию предпочтительно образование вторичного катиона (I), поскольку он более стабилен: положительный заряд на вторичном атоме углерода в большей степени компенсируется за счет + I-эффектов соседних алкильных радикалов.
Образование карбкатиона является стадией, лимитирующей кинетику реакции. В процессе вовлечения протониевого иона в реакцию предпочтительно образование вторичного катиона (I), поскольку он более стабилен: положительный заряд на вторичном атоме углерода в большей степени компенсируется за счет + I-эффектов соседних алкильных радикалов.
Карбкатион (II) менее стабилен, поскольку положительный заряд сосредоточен на первичном углеродном атоме.
Стабильность карбкатионов убывает от третичных к первичным:

Следовательно, в реакциях присоединения молекул типа HX (X – галоген; OH, HSO4, CN и др.) к несимметричным алкенам механизм присоединения должен включать образование промежуточного циклического продукта с карбкатионной природой (в рассматриваемом примере – это циклический протониевый ион). Именно этим можно объяснить стереоселективность реакции электрофильного присоединения.
Таким образом, процесс присоединения несимметричных реагентов типа HX к алкенам протекает в том преимущественном направлении, которое обеспечивает образование наиболее стабильного карбкатиона.
Присоединение серной кислоты. Будучи H-электрофилом, серная кислота присоединяется к алкенам с образованием алкилсульфатов:

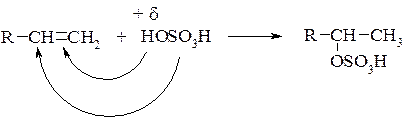
Здесь также реализуется механизм, описанный выше, и ориентация присоединения происходит в соответствии с правилом Марковникова.
Дата добавления: 2020-10-01; просмотров: 689;











