Физические свойства
Углеводороды, содержащие от одного до четырёх атомов углерода, – газы. Соединения с С5 и до С17 – жидкости, а выше – твёрдые вещества.
С увеличением длины цепи на один атом углерода температуры кипения углеводородов повышаются на 20-30°С, за исключением метана, этана и пропана. Нормальные алканы (т.е. с неразветвлённой цепью) имеют более высокие температуры кипения, чем их изомеры. Алканы неполярны и поэтому практически нерастворимы в воде, но хорошо растворяются в неполярных и малополярных органических растворителях. В чистом виде они бесцветны и имеют слабый запах
Химические свойства алканов
В обычных условиях углеводороды ряда метана характеризуются высокой химической инертностью, что, прежде всего, связано с прочностью С-С и С-Н связей. Более того, связи С-Н практически неполярны из-за близких значений электроотрицательностей: Сsp3=2.5; H=2.1 по шкале Полинга. Очень низкая поляризуемость связи С-Н говорит о том, что для гетеролитического разрыва такой связи требуется значительная энергия. Расчёты свидетельствуют, что энергия гомолитического разрыва связи С-Н примерно в три раза меньше, чем гетеролитического. По этой причине для алканов более предпочтительны гомолитические реакции с образованием промежуточных частиц – радикалов.
Галогенирование
Хлорирование метана можно представить в виде последовательных реакций замещения:
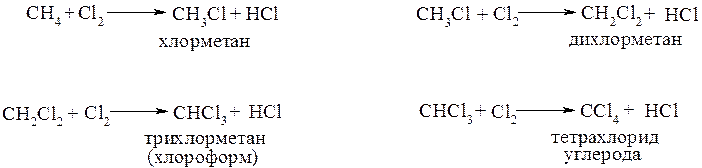
Заметно реакция начинает развиваться, если смесь метана с хлором нагреть до 200°С или облучить УФ-светом. При более высокой температуре и/или ультрафиолетовом облучении реакция протекает очень быстро.
Хлорирование метана и других алканов является типичной цепной радикальной реакцией.
При высокой температуре (≈400°С) и/или интенсивном облучении происходит гомолитическое расщепление связей.
Молекула хлора расщепляется на два атома (гомолитический разрыв связи). Эта стадия называется зарождением цепи, поскольку образующиеся радикалы далее вызывают цепь последовательных реакций, протекающих по SR-механизму:


Возможен и другой процесс – обрыв цепи: два метильных радикала взаимодействуют между собой, рекомбинируясь в этан, а два атома хлора – в молекулу Cl2:

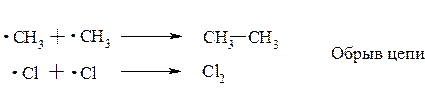
Процесс галогенирования относится к цепным химическим реакциям*.
Аналогичные реакции происходят при взаимодействии метана с фтором и бромом, причём реакционная способность галогенов изменяется в такой последовательности: F2>Cl2>Br2. Реакция с фтором протекает со взрывом в темноте при комнатной температуре, поэтому процесс ведут на холоду и в присутствии благородного газа.
Взаимодействие алканов с бромом осуществляется с высокой избирательностью, вследствие чего образуется преимущественно один изомер.
Если алкан имеет разветвлённое строение и содержит первичные, вторичные и третичные атомы углерода, то при галогенировании замещение преимущественно происходит по третичному углеродному атому.
При изменении температурного режима реакция хлорирования протекает по-разному: инициируемое облучением хлорирование пропана при 25°С приводит к смеси продуктов:
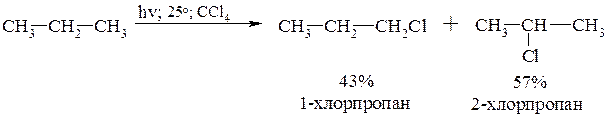
В реакции хлорирования избирательность замещения увеличивается с понижением температуры.
При бромировании образующийся радикал брома менее реакционоспособен и избирательность замещения очень высока:

Нитрование. Нитрование алканов под действием 10-20%-й азотной кислоты при нагревании впервые осуществлено М.И. Коноваловым (1888г.). В этой связи данный процесс называется реакцией Коновалова. Такой способ нитрования является жидкофазным., так как проводится при 150º С и под давлением. Например, в этих условиях можно получить 2-нитрогексан с выходом 63%.
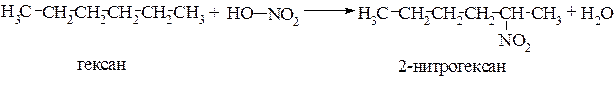
В условиях реакции Коновалова селективность нитрования аналогична галогенированию, т.е. в первую очередь легче замещается водород у третичного углеродного атома, затем вторичного и труднее всего у первичного.
В дальнейшем был предложен метод парофазного нитрования при температуре 400-500°С. Данный метод имеет существенный недостаток: из-за высокой температуры происходит разрыв С-С -связей (крекинг), что приводит к образованию сложной смеси продуктов замещения.
Известно, что в азотной кислоте всегда присутствует NO2, высокая химическая активность которого обусловлена сильной поляризацией молекулы и наличием неспаренного электрона. В условиях парофазного нитрования именно эта частица запускает реакцию, что можно представить в виде следующих последовательных процессов:
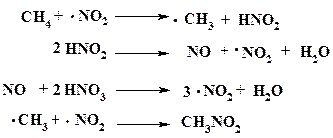
Стабильность радикала ·NO2 в этих условиях высока и он быстро реагирует с метильным радикалом. Следствием этого является низкая концентрация ·СH3 в реакционной смеси, что в свою очередь сводит к минимуму развитие побочных радикальных реакций.
Сульфохлорирование. Взаимодействие алканов с оксидом серы IV в присутствии хлора называется сульфохлорированием и относится к цепным реакциям. В общем виде процесс можно представить в виде реакций:
CH3–(CH2)n–CH3 + SO2 + Cl2 → CH3–(CH2)n– CH2–SO2Cl + HCl
Механизм реакции аналогичен галогенированию:
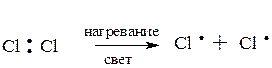
CH3–(CH2)n–CH3 + Cl· → CH3–(CH2)n–CH2· + HCl
CH3–(CH2)n–CH2· + SO2 → CH3 (CH2)n–CH2SO2·
CH3–(CH2)n–CH2SO2· + Cl2 → CH3–(CH2)n–CH2SO2Cl + Cl·
Реакция сульфохлорирования широко используется в производстве моющих средств на основе углеводородов, содержащих 12 – 18 атомов углерода.
Дегидрирование. При высоких температурах (≈650°С) алканы могут подвергаться дегидрированию. В зависимости от типа катализатора (металлы или оксиды металлов) из алкана образуется либо алкен, либо алкадиен. Данная реакция используется при дегидрировании бутан – бутеновой фракции переработки нефти:

2-Метилбутан, содержащийся в изопентан–изопентеновой фракции переработки нефти, переходит в изопрен:
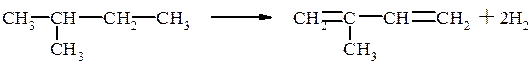
При дегидрировании фракций переработки нефти, содержащих шесть или более атомов углерода, возможно образование циклических соединений, в том числе и ароматических:
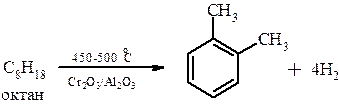
Это метод дегидрирования называется дегидроциклизацией алканов и ароматизацией нефти.
Изомеризация алканов. Под влиянием кислот Льюиса и при высоких температурах н-алканы, начиная с бутана, могут переходить (изомеризоваться) в изоалканы и наоборот. Чем больше углеродных атомов, тем легче изомеризация. Обычно образуется равновесная смесь:
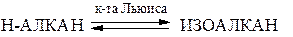
Окисление. В избытке кислорода и при температуре выше 300°С алканы легко сгорают с образованием CO2 и H2O. Реакция экзотермическая и сопровождается выделением большого количества теплоты:
CH4 + 2O2 → CO2 + H2O; Δ H = -804 кДж/моль
В обычных же условиях сильные окислители не действуют на алканы.
Окисление алканов в жидкой или газообразной фазе кислородом или воздухом при температуре 150 – 200° С сопровождается разрывом углерод - углеродных связей и образованием преимущественно карбоновых кислот в качестве конечных продуктов. Таким путём, например, из бутана можно получить уксусную кислоту:
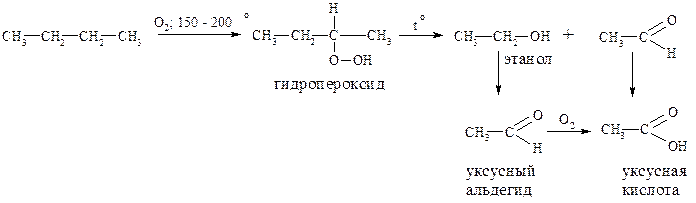 Вопросы для самоподготовки
Вопросы для самоподготовки
1. Напишите формулу и название изомера октана, в состав которого входят только первичные и четвертичные атомы углерода. Предложите схему его синтеза из 2-метилпропана.
2. Путём последовательных реакций получите из ацетата натрия изобутан. Напишите для него уравнения реакций нитрования (по Коновалову) и бромирования. Объясните механизм этих реакций и причину, по которой преимущественно образуются третичные нитро- и бромпроизводные.
3. На смесь хлорметана и 2-хлорпрорпана подействовали металлическим натрием. В результате получили смесь трёх алканов. Напишите формулы и названия этих алканов.
4. Получите 2-метилбутан из соответствующего алкина. Напишите для него уравнения реакций сульфоокисления и сульфохлорирования. Сколько изомерных продуктов образуется в каждой из этих реакций?
5. На 1,3-дибром-2-метилпропан последовательно подействовали 1) цинком; 2) бромоводородом; 3) металлическим натрием. Напишите уравнения всех реакций, назовите все соединения.
6. Запишите уравнения реакций, с поощью которых из метана получают п-аминобензойную кислоту.
Глава 6. Алкены
Дата добавления: 2020-10-01; просмотров: 717;











