Относительная и абсолютная конфигурация
В стереохимической номенклатуре используют две системы обозначения стереоизомеров – D,L и R,S. В D/L-системе описывается только относительная конфигурация соединений, поскольку она основана на сравнении конфигурации анализируемого оптически активного вещества с конфигурацией эталонного вещества.
В качестве таких эталонных веществ используют D- и L-глицериновый альдегид (для описания конфигурации гидроксикислот и моносахаридов), а также D- и L-серин (при описании конфигурации аминокислот).
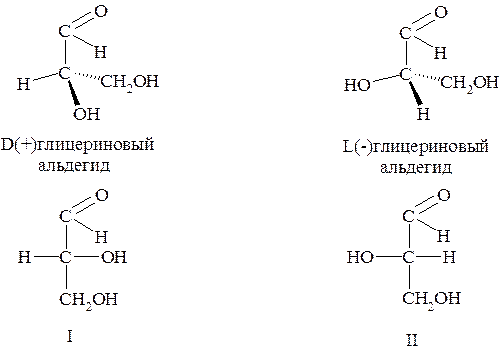
Заметим, что правовращающему (+) глицериновому альдегиду произвольно была приписана структура I, а левовращаемому (-) глицериновому альдегиду – структура II. Префиксы D (от «dextrum» - правый) и L (от «laevus» - левый) придаются названию веществ по определению и относятся исключительно к конфигурации хирального центра.
Когда хотят обозначить принадлежность вещества к D- или L- конфигурационным рядам, пользуются проекционными формулами Фишера, в которых углеродную цепь ориентируют вертикально. При этом альдегидную или эквивалентную ей по старшинству группу (например, -СООН) изображают вверху, а группу -СН2ОН (или вместо неё -СН3) располагают снизу. Далее определяют направление движения от атома водорода в хиральном центре к гидрогсигруппе через альдегидную (или карбоксильную) группу. Аналогичную операцию проводят и с изомерной формулой.
Если направление движения от Н к ОН вокруг хирального центра совпадает с направлением движения часовой стрелки, то формуле приписывают префикс D; если же движение противоположно часовой стрелке – то префикс L.
Таким образом, данная система обозначений позволяет только лишь относить стереоизомеры к D- или L-конфигурационным рядам без каких-либо намёков на вращение.
Следовательно, не обязательно, чтобы, например, вещество, относящееся к D-конфигурационному ряду, вращало плоскость поляризации вправо, а L-ряда – влево. Так, левовращающая молочная кислота относится к D-конфигурационному ряду, а правовращающая – к L-ряду. В таких случаях знаками «+» или «-» после символов D и L указывают соответствующее вращение:
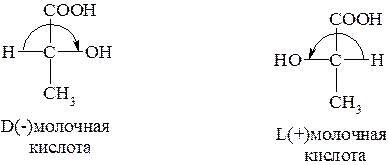
В настоящее время номенклатурные правила IUPAC не запрещают использовать D/L систему обозначений стереоизомеров в химии углеводов и аминокислот.
Для молекул, содержащих несколько хиральных центров, число оптических изомеров будет соответствовать формуле N=2n, где N-количество возможных изомеров, а n – число асимметрических углеродных атомов. Однако, если такая молекула обладает некоторыми элементами симметрии, то число изомеров будет меньше.
Рассмотрим в качестве примера винную (дигидроксиянтарную) кислоту, содержащую два асимметрических углеродных атома.
Пользуясь D/L системой обозначений, напишем все возможные изомеры:

Известны четыре формы винных кислот:
I – (+) винная кислота, которая встречается в природе;
II – (-) винная кислота, полученная из виноградной кислоты;
III, IV – мезовинная (или антивинная кислота).
Структуры I и II соотносятся между собой как зеркальные изомеры, т.е. являются оптическими антиподами.
Структура III – мезовинная кислота – имеет плоскость симметрии, которая обозначена пунктирной линией: она оптически неактивна. Таким образом, в мезовинной кислоте имеет место «внутренняя компенсация» знака вращения.
Из представленных структур видно, что I, II и III различны между собой.
Соединения I и II являются энантиомерами (антиподами). Пары веществ I и III, а также II и III являются диастереомерами. Обращает на себя внимание тот факт, что у таких пар веществ конфигурация одного хирального центра одинакова (для I и III – это С-2; II и III – это С-3), а у другого разная (для I и III – это С-3; II и III – это С-2).
Таким, образом, диастереомеры – это пространственные изомеры, отличающиеся конфигурацией части имеющихся в них элементов хиральности и не являющиеся оптическими антиподами.
Рассмотренный тип диастереомерии обозначается как σ-диастереомерия.
Для соединений с двумя асимметрическими атомами иногда используют способ обозначения диастереомеров по аналогии с эритрозой и треозой. Различие между ними заключается в расположении одинаковых атомов или групп атомов относительно плоскости σ-связи между асимметрическими атомами углерода.

Обобщая изложенное выше, можно заключить, что экспериментальное определение знака вращения с помощью поляриметра не позволяет ответить на вопрос, какой энантиомер конкретно соответствует данному знаку вращения.
Об истинном расположении атомов или атомных групп вокруг хирального центра судят по абсолютной конфигурации.
В настоящее время существуют лишь два независимых метода определения абсолютной конфигурации – это рентгеноструктурный анализ и теоретический расчёт.
Для обозначения абсолютной конфигурации используют более строгую систему описания стереоизомеров, известную под названием R,S-номенклатуры (от латинского rectus – правый; sinister – левый) Кана-Ингольда-Прелога. В основе этой системы лежит принцип последовательного уменьшения старшинства заместителей. Суть этих правил сводится к следующим положениям.
1. Для атомов, непосредственно связанных с асимметрическим атомом углерода, старшинство убывает в порядке уменьшения порядкового номера элемента:
53I > 35Br > 17Cl > 9F > 1H; OH > NH2 > CH3 > H
2. В том случае, когда старшинство нельзя определить с помощью правила 1, то его необходимо определять по порядковому номеру второго (или последующего) атома:
CH2Cl > CH2OH > CH2NH2 > CH2CH3 > CH3;
CH2CH2OH > CH2CH2NH2 > CH2CH2CH3.
3. Если второй, или последующий атомы одинаковы, но число таких атомов различное, то старшим считается группа, которая содержит больше заместителей с большим порядковым номером:
CHCl2 > CH2Cl
4. В том случае, когда заместитель, связанный с асимметрическим атомом, содержит кратные связи, то каждый из атомов при двойной связи считается за два, а при тройной связи - за три:
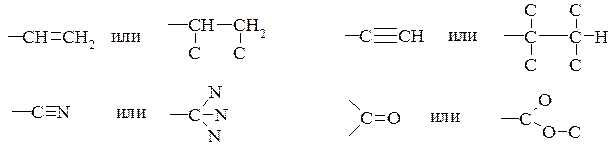
тогда старшинство убывает в следующей последовательности:
–СООСН3 > –COOH > –CONH2 > –COCH3 > –CHO> –C≡N > –C≡CH > –CH=CH2
Для отнесения молекулы к R- или S-системе заместители у асимметрического атома углерода Хabcd располагают в порядке убывания старшинства, исходя из того, что a > b > c > d. Хиральный центр рассматривают так, чтобы самый младший заместитель d был максимально удалён от наблюдателя. Если у оставшихся трёх заместителей a, b, c старшинство убывает по часовой стрелке, то конфигурация хирального центра получает символ R (от латинского rectus – правый). Если же старшинство заместителей убывает против часовой стрелки, то конфигурация хирального центра получает символ S (от латинского sinister – левый).
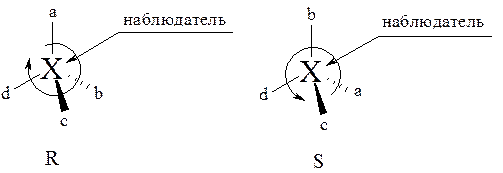
Пользуясь правилами старшинства заместителей, можно понять, что (+) молочная кислота имеет S-конфигурацию, а (+) глицериновый альдегид имеет R-конфигурацию.

Экспериментальное определение абсолютной конфигурации правовращающей винной кислоты показало, что у обоих асимметрических атомов конфигурация соответствует R, а левовращающей – S. У мезовинной кислоты R (у С-2) и S (у С-3).
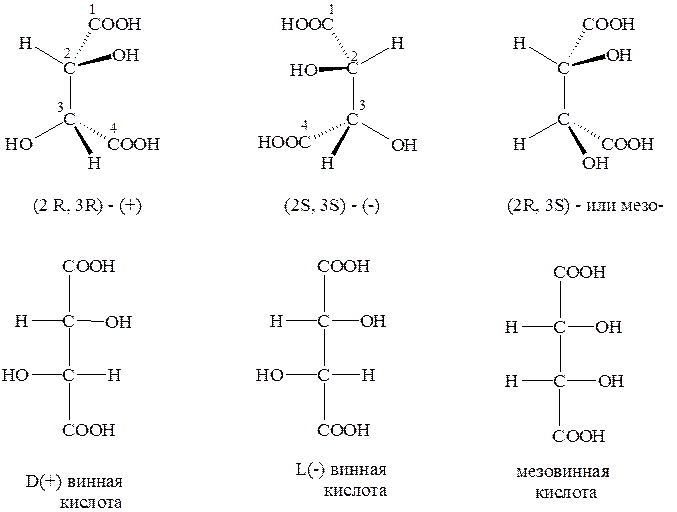
Причиной хиральности органических молекул может быть не только наличие асимметрических атомов углерода.
Если рассматривать 1,3-дизамещённые циклобутаны, или 1,4-дизамещённые циклогексаны, то можно убедиться, что они имеют только одну плоскость симметрии. При этом заместители могут располагаться по разные стороны от плоскости цикла.
В приведённых ниже примерах одинаковые по старшинству заместители в каждой паре располагаются по одну или по разные стороны цикла, что в стереохимии обозначается соответственно префиксами цис- и транс-. Такие пары стереоизомеров также являются диастереомерами.
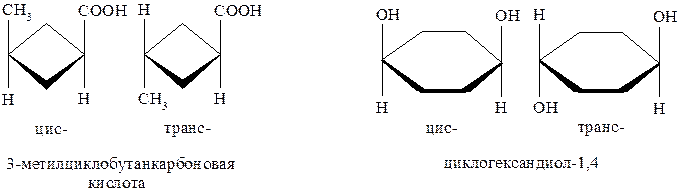
Для алкенов также характерна цис- транс- изомерия. Устойчивость этих изомеров объясняется прежде всего тем, что π-связь препятствует свободному вращению атомов или атомных групп по оси σ-связи между атомами углерода. Переход одного изомера в другой возможен при высоких температурах, УФ-облучении и т.п.
Данный вид изомерии в алкенах называют цис- транс- или геометрической изомерией, а такие пары веществ являются π-диастереомерами.
В более общем случае для алкенов, отвечающих общей формуле abC=Ccd, должно соблюдаться условие a≠b и c≠d, хотя возможно a=c и b=d.
Использование префиксов цис- и транс- целесообразно лишь тогда, когда a=c и b=d:
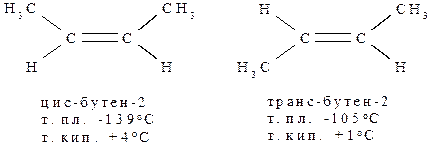
Всё же по современной номенклатуре IUPAC более предпочтительно использование E,Z-системы, основанной на учёте правил последовательного старшинства заместителей. Та конфигурация, в которой по одну сторону от плоскости π-связи располагаются старшие заместители, обозначают префиксом «Z» (от немецкого zusammen – вместе). Конфигурация, в которой старшие заместители находятся по разные стороны от плоскости π-связи, обозначают префиксом «Е» (от немецкого entgegen – напротив).
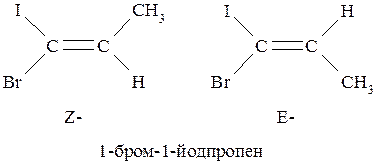
Если молекула содержит несколько двойных связей, то префиксы Z- и Е- указывают с соответствующей цифрой, характеризующей положение конкретной двойной связи:
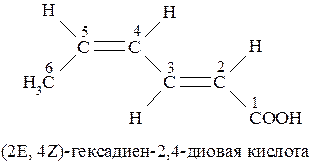
Если при нумерации цепи может возникнуть возможность разночтения, то преимущество в выборе наименьших числовых обозначений (локантов) получает та двойная связь, которая имеет Z-конфигурацию (Z-группы старше Е):
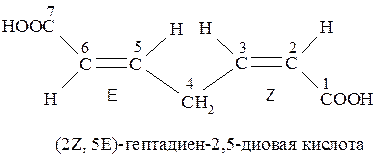
Вопросы для самоподготовки
1. Два изомера алкана имеют состав С8H18 . Первый содержит в молекуле один асимметричный атом С, другой – два . Назовите эти алканы и приведите формулы Фишера для их пространственных изомеров. Объясните, какой из них обладает оптической активностью?
2. Определите тип гибридизации атомов углерода в 2-метилпентадиене-1,3 и 2-метилпентадиене-1,4. Для какого из них возможна геометрическая изомерия? Назовите эти изомеры.
3. Напишите формулу изомеров веществ, приведенных в пункте 2, в которых есть только один sp –гибридный атом углерода.
4. Объясните понятия энантиомер и диастереомер на примере винной кислоты.
5. Какой принцип лежит в основе отнесения веществ к D,L-конфигурационным рядам?
6. Как используется старшинство заместителей при построении R,S-конфигурационных рядов?
Глава 5. Алканы
Алканы* (предельные, насыщенные углеводороды) – это наиболее простой класс органических соединений, отвечающий общей формуле CnH 2n+2. Здесь атомы углерода находятся только в состоянии sp3-гибридизации. Каждый атом углерода в алканах удобно классифицировать с точки зрения числа связанных с ним других углеродных атомов, что иллюстрируется примерами:
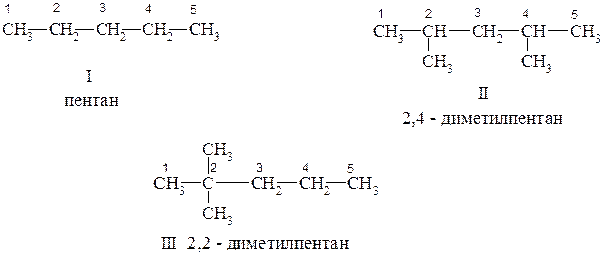
Атомы углерода, связанные только с одним углеродным атомом, называются первичными (во всех трёх соединениях – это концевые метильные группы, а также CH3 группы в положениях 2,4 соединения II и в положениях 2,2 соединения III).
Если атом углерода связан с двумя другими атомами углерода, то он называется вторичным (атомы С-2, С-3, С-4 в соединении I; С-3 в соединении II и С-3, С-4 в соединении III).
Атом, связанный с тремя другими атомами углерода, называется третичным (атом С-2 и С-4 в соединении II).
Наконец, когда атом связан с четырьмя другими атомами углерода, то он считается четвертичным (C-2 в соединении III).
Способы получения
Главными промышленными источниками получения алканов являются природный газ и нефть. Переработку нефти и различных её фракций в промышленности осуществляют преимущественно таким методом как крекинг.
Совокупность реакций, происходящих при термическом распаде алканов, называют крекингом. Данный процесс, сопровождающийся гомолитическим разрывом С-С и С-Н связей, приводит к образованию промежуточных радикалов, из которых далее образуются низкомолекулярные алканы, алкены и карбоциклы.
Сn H 2n+2 → Сm H 2m+2 + Cp H 2p.
При крекинге метана (t≈800°C) образуется смесь, преимущественно состоящая из ацетилена и водорода:
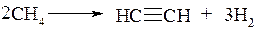
Этан в этих условиях разлагается в соответствии с суммарной реакцией
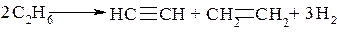
Очень важно отметить, что промышленная переработка нефти, как наиболее богатого и разнообразного по составу источника углеводородов, в большей степени, к сожалению, служит нуждам энергетики, а также сгорает в двигателях внутреннего сгорания.
Путём термического крекинга возможно расщепление алканов керосиновой фракции (С10 - С15) и солярной фракции (С12 – С20). Однако, полученный таким путём бензин невысокого качества (октановое число не более 65).
На современных перерабатывающих предприятиях термический крекинг практически полностью заменён каталитическим крекингом. Он обычно проводится в газовой фазе (400-450°С) и под давлением 10-15 атм в присутствии алюмосиликатного катализатора.
Большое практическое значение получил синтез углеводородов из оксида углерода (II) и водорода (метод Фишера-Тропша). При температурном режиме 250°С и в присутствии никелевого катализатора получают метан:

Если в качестве катализатора использовать железо и кобальт, то можно получать смесь углеводородов (синтин), содержащих от 12 до 18 углеродных атомов:

Кроме природных источников получения алканов широко используют и многочисленные синтетические способы, которые можно разделить на три группы.
Первую группу составляют реакции, в которых исходные вещества и конечные продукты содержат одинаковое число атомов углерода. К ним относятся следующие реакции:
а) гидрирование непредельных углеводородов:
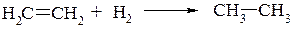
б) восстановление галогенопроизводных водородом или йодоводородом
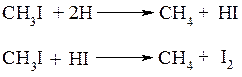
Ко второй группе реакций относят реакции, при которых полученный продукт содержит больше углеродных атомов, чем исходное вещество. Особо следует отметить взаимодействие галогенопроизводных с металлическим натрием (реакция Вюрца):

Данная реакция более интересна с точки зрения получения симметричных алканов из двух молей одинаковых исходных соединений. Если же исходными веществами являются разные галогенопроизводные, то, как правило, образуется смесь трёх алканов:
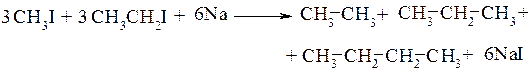
Модифицированный вариант этой реакции, называемой реакциейВюрца-Фиттига, используют для получения алкилзамещённых аренов (см. 10.1.)
Для наращивания цепи углеродных атомов применяют реакцию Кольбе, которая по сути представляет собой электролиз солей одноосновных карбоновых кислот. Кислотный остаток на аноде окисляется до радикала CH3COO•, который далее распадается с образованием CO2 и алкильного радикала. Два таких радикала, соединяясь, образуют алкан:
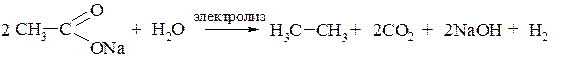
К третьей группе относятся реакции, при которых полученный продукт содержит меньше углеродных атомов, чем исходное соединение. Примером такого способа является расщепление солей карбоновых кислот при сплавлении с щёлочью:
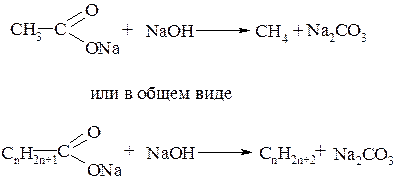
Дата добавления: 2020-10-01; просмотров: 814;











