Определение Брёнстеда – Лоури
Данная система представлений характеризует кислоты, как вещества, высвобождающие протоны (доноры протонов), а основания – как вещества, способные соединяться с протонами (акцепторы протонов).
Теряя протон, кислота превращается в основание, поскольку в результате обратной реакции оно может присоединить протон. Аналогично, основание, присоединив протон, переходит в кислоту. Такая взаимосвязь между кислотами и основаниями может быть выражена уравнениями:
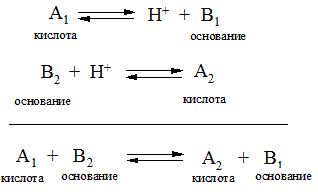
Вещества А1 и В2 называют сопряженной парой, поскольку кислота А1 образует сопряженное ей основание В1, а основание В2 – сопряженную кислоту А2. Ниже представлены сопряженные пары:

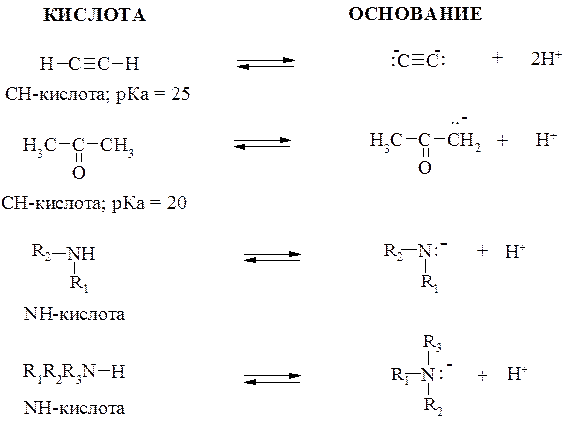
Из курса общей химии известно, что согласно Брёнстеду – Лоури сила кислоты определяется константой кислотности Ка, а сила основания определяется константой основности Кв. Чем меньше рКа, тем больше кислотность по Брёнстеду – Лоури. Основность соединений оценивают по величине рКа сопряженной кислоты: чем больше рКа сопряженной кислоты, тем больше основность соединения.
Определение Льюиса
В данном случае предложено более общее определение, в соответствии с которым кислота – это вещество, которое акцептирует электронную пару, а основание- это вещество, которое предоставляет электронную пару.
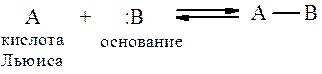
Кислотами Льюиса, например, являются BF3, AlCl3, FeCl3, NO+ (катион нитрозония), NO2+ (катион нитрония), SO3, H+ и другие. Особенностью кислот Льиса является то, что они не имеют собственных протонов, но, будучи координационно-ненасыщенными нейтральными молекулами (BF3, AlCl3 и др.), или содержащими вакантную орбиталь, стремятся дополнить свою электронную оболочку парой электронов за счет присоединения аниона или нуклеофила:
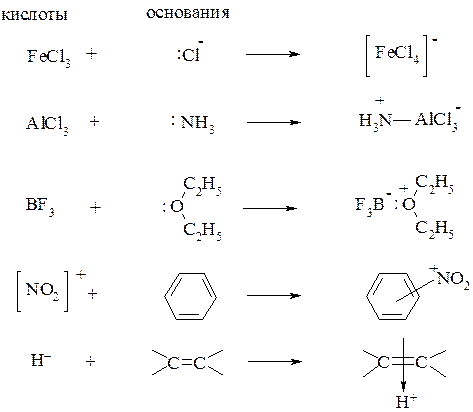
Дата добавления: 2020-10-01; просмотров: 484;











