Метод валентных связей (МВС)
Первой квантово-механической теорией двухэлектронной связи была теория строения молекулы водорода, предложенная В. Гейтлером и Ф. Лондоном в 1927 г., которая в 30-х годах была развита Л. Полингом и другими исследователями во всеобъемлющую теорию химической связи, названную методом валентных связей (МВС) или локализированных электронных пар.
МВС исходит из следующих положений: 1) химическая ковалентная связь образуется за счёт спаривания двух электронов, имеющих противоположный спин и принадлежащих разным атомам; 2) при образовании молекулы электронная структура атомов, входящих в её состав практически сохраняется, за исключением наружных оболочек. Все химические связи в молекуле могут быть представлены в виде фиксированных (локализованных) двухцентровых двухэлектронных связей. Каждая такая связь в схемах изображается короткой линией, а электронная структура молекулы выглядит как набор различных валентных схем (ВС), в связи с чем этот метод иначе называют методом локализованных пар.
Так, водород представляет собой систему из двух электронов и двух протонов. Если два атома водорода удалены друг от друга на некоторое расстояние, то в МВС при построении волновой функции электронов молекулы исходят из волновых функций электронов составляющих атомов. Обозначив волновые функции электронов изолированных атомов НА и НВ через ψ А (1) и ψ В (2) соответственно, получим выражение для волновой функции молекулярной системы:
ψ 1= ψ А (1) ψ В (2). (2.3)
Поскольку электроны в Н2 неразличимы, то нет оснований считать, что в этой молекуле электрон l принадлежит ядру атома НА, а электрон 2 – ядру атома НВ. Следовательно, вероятно и обратное распределение, поэтому уравнению (2.3) эквивалентно уравнение (2.4):
ψ2= ψ А (2) ψ В (1). (2.4)
По Гейтлеру и Лондону, волновая функция молекулы водорода представляет собой линейную комбинацию функции ψ 1 и ψ 2:
ψков.= ψ 1 + ψ 2. (2.5)
Кроме ковалентной структуры (I) для молекулы Н2 можно допустить и существование двух ионных структур (II) и (III), которые соответственно могут быть охарактеризованы волновыми функциями ψ 3 и ψ 4:
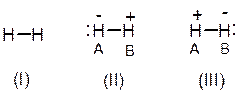
Существование структур (II) и (III) возможно при условии смещения электронов в сторону атома А (II) и атома В (III).
Волновая функция для ионных структур может быть записана
ψ ион = ψ 3+ ψ 4 = ψ а (1) ψ А (2) + ψ В (1) ψ В (2) (2.6)
В конечном итоге полная волновая функция молекулы Н2 с учетом всех структур может быть представлена в виде
ψ н2 = ψ ков + ψ ион. (2.7)
В уравнении (2.7) учтены одновременно все валентные схемы для молекулы водорода, поэтому функция φн2 представляет собой наложение структур (I), (II) и (III). Поэтому важное значение приобретает понятие резонанса: если молекула может быть представлена двумя или более структурами, которые отличаются только распределением электронов, но атомные ядра в них расположены одинаково, то становится возможным резонанс. Это означает, что структуру молекулы можно изображать с помощью разных гипотетических (канонических) структур в тех случаях, когда для объяснения свойств данной молекулы не может быть использовано только одно, единственное описание распределения электронов.Молекула представляет собой гибрид этих структур и не может быть удовлетворительно представлена ни одной из них. Каждая из них вносит свой вклад в гибрид, который стабильнее, чем любая из участвующих в резонансе. Необходимо учесть, что понятие резонанса возникает как следствие построения волновой функции в методе ВС.
При образовании связи электроны должны находиться между ядрами атомов, то есть в области связывания. Когда же электроны находятся вне этой области, то она называется антисвязывающей или разрыхляющей, и связь не образуется. Поскольку в связывающем состоянии электроны втягиваются в область между ядрами, а в разрыхляющем — выталкиваются, то волновую функцию Н2 обозначают ψ+, а функцией ψ- описывают разрыхляющее состояние. Поэтому уравнение может быть записано в виде двух самостоятельных выражений:
ψ + = ψ А (1) ψ В (2)+ψ А (2) ψ В (1), (2.8)
ψ - = ψ А (1) ψ В (2)-ψ А (2) ψ В (1). (2.9)
Из уравнения (2.8) видно, что перестановка электронных координат (1) и (2) не влияет на знак функции ψ +. Такая функция называется симметричной. В уравнении же (2.9) перестановка координат электронов приводит к изменению функции – ψ.Поэтому функция ψ- называется антисимметричной .
При использовании ψ+ электроны в атоме характеризуются различными спиновыми квантовыми числами, то есть имеют антипараллельные спины. Симметричным и антисимметричным волновым функциям отвечают различные распределения электронного облака в молекуле Н2 между ядрами атомов.
Итак, в симметричной волновой функции имеются антипараллельные спины электронов, поэтому их волновые функции суммируются, что, в свою очередь, приводит к увеличению электронной плотности между ядрами. Следовательно, когда имеет место ψ+, то происходит перекрывание волновых функций электронов, или, как иначе говорят, перекрывание электронных облаков.
Для антисимметричной волновой функции электроны характеризуются параллельными спинами, поэтому наблюдается уменьшение электронной плотности между ядрами атомов, что говорит об отсутствии возможности образования химической связи. При этом электронная плотность между ядрами падает до нуля.
Таким образом, для формирования ковалентной связи должны соблюдаться следующие условия:
а) два электрона могут образовать ковалентную связь только в том случае, если они имеют антипараллельные спины;
б) взаимодействие электронов с антипараллельными спинами сопровождается перекрыванием орбиталей, в результате чего между ядрами взаимодействующих атомов увеличивается электронная плотность, что приводит к уменьшению энергии системы;
в) ковалентная связь направлена в сторону наибольшего перекрывания орбиталей взаимодействующих атомов.
Так как теория валентных связей исходит из представления об образовании ковалентных связей в результате перекрывания атомных орбиталей, то критерий положительного перекрывания атомных орбиталей имеет исключительную ценность для установления возможности образования связи.
Орбитали называются перекрывающимися, если взаимодействующие атомы сближаются настолько, что одна из орбиталей каждого из них имеет значительную амплитуду в пространстве, общем для обоих атомов. В зависимости от свойств орбиталей величина перекрывания может быть положительной, отрицательной или нулевой.
Положительное значение перекрывания наблюдается в том случае, когда перекрывающиеся области обеих орбиталей имеют один и тот же знак; отрицательное значение перекрывания имеет место, если перекрывающиеся области обеих орбиталей имеют противоположные знаки. Если же имеются абсолютно равные области отрицательного и положительного перекрывания, то в целом характерно нулевое перекрывание. В области положительного перекрывания электронная плотность между ядрами атомов повышается, поэтому притяжение ядер к связующим электронам преобладает над взаимным отталкиванием и возникает связывающее взаимодействие.
Положительное перекрывание двух орбиталей следует рассматривать как новую, так называемую молекулярную орбиталь(МО). При отрицательном перекрывании электронная плотность между ядрами взаимодействующих атомов уменьшается, поэтому межъядерное отталкивание возрастает, что приводит к избыточному отталкиванию между ними.
Когда же перекрывание равно нулю, то между атомами не наблюдается ни уменьшения, ни увеличения электронной плотности, вследствие чего нет ни отталкивания, ни дополнительного притяжения. Такое состояние называется несвязывающим взаимодействием.
Метод ВС в своей простейшей форме даёт не совсем удовлетворительное описание химической связи, поскольку трудно перенести его на неэмпирический уровень для всех молекул, за исключением простейших.
Дата добавления: 2020-10-01; просмотров: 613;











