Свойства ковалентной связи
Важнейшими параметрами, определяющими химическую связь являются: длина, валентные углы, энергия, насыщаемость и направленность, кратность, полярность и поляризуемость.
Длина связи – среднее расстояние между центрами химически связанных атомов. При сближении двух атомов между ними возникает слабое ван-дер-ваальсово взаимодействие. Когда межъядерное расстояние становится сравнимо с размерами электронных оболочек, между атомами появляются два конкурирующих вида взаимодействия:
1) ядро одного атома с электронами другого атома;
2) отталкивание, действующее между одноимённо заряженными ядрами и электронами обоих атомов.
Вначале преобладает первый вид взаимодействия, т.е. притяжение, в связи с чем энергия продолжает уменьшаться вплоть до образования стабильной молекулы. При дальнейшем сближении атомов начинают превалировать силы отталкивания, резко возрастающие на коротких расстояниях. Межъядерное расстояние между химически связанными атомами называется длиной связи.
Таким образом, атомы, участвующие в образовании химической связи, совершают колебательные движения в пределах некоторого оптимального расстояния.
В органических соединениях длины связей зависят не только от природы взаимосвязанных атомов, но и от типа гибридизации.
Так в случае sp3- гибридизации длина Сsp3–Сsp3 связи составляет 0,154 нм, а Сsp3–Н связи – 0,110 нм. Если атом углерода sp2-гибридизован, то длина Сsp2=Сsp2 связи равна 0,134 нм, а Сsp2–Н – 0,107 нм. Наконец, Сsp≡ Сsp равна 0,120 нм, Сsp–Н – 0,106 нм.
Валентный угол - угол между воображаемыми прямыми, проходящими через ядра двух химически взаимосвязанных атомов, называется валентным углом.Так, в молекуле воды этот угол равен 104,5о:
Рис. 2.9. Строение молекулы воды

В органических молекулах величина валентного угла коррелирует с типом гибридизации атома углерода: 109,5о – для Сsp3-атома; 120о – для Сsp2 и 180о – для Сsp. Однако есть ряд особенностей, на которые следует обратить внимание: только в молекуле метана и подобных ему симметричных молекулах – CCl4; С(СН3)4 валентный угол соответствует 109,5о. При переходе к гомологам метана наблюдается уплощение и валентный угол отклоняется в большую сторону.
В этилене, где углерод sp2-гибридизован, валентный угол составляет 120о а в ацетилене (Сsp) этот угол уже равен 180о.
Энергия связи – это энергия, которую необходимо затратить для разрыва химической связи между атомами. Данная характеристика служит мерой прочности химической связи и может быть определена экспериментально. Чем выше энергия связи, тем она прочнее. Как правило, наиболее устойчивы связи между атомами, у которых значение электроотрицательности находится в пределах 2–2,5. Например, для Сsp3–H – 414 кДж/моль; Csp3–Csp3 – 335 кДж/моль; С=С – 615 кДж/моль; С≡С – 833 кДж/моль.
Нельзя путать энергию разрыва связи и энергию связи. Энергия разрыва связи представляет собой действительную энергию, необходимую для разрыва данной связи в молекуле, а энергия связи – полная теплота распада связей в газообразной молекуле.
Насыщаемость ковалентной связи определяет стехиометрию молекулярных химических соединений. Теория ВС исходит из положения, что каждая пара атомов в молекуле удерживается с помощью одной или нескольких электронных пар. Из этого следует, что химическая связь локализована между двумя атомами, т.е. она двухэлектронная и двухцентровая. Если каждую пару связующих электронов обозначить чёрточкой, то такое изображение связей в молекулах позволит судить о том, в какой степени один атом насыщается другим атомом. Вследствие этого молекулы имеют определённый состав и существуют в виде дискретных частиц с определённой структурой.
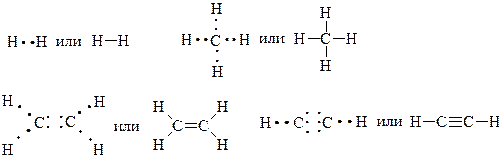
Таким образом, насыщаемость указывает на способность данного атома соединяться с максимальным числом других атомов с образованием ковалентной связи.
Дата добавления: 2020-10-01; просмотров: 470;











