Ковалентная связь, молекулярные орбитали которой охватывают более двух атомов, называется делокализованной.
Рассмотрим бутадиен-1,3. Изучение бутадиена-1,3 позволило установить следующее строение (рис.2.14):
Рисунок 2.10. Строение бутадиена-1,3
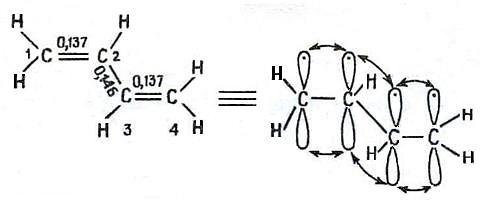
Длина связей между С1 и С2, С3 и С4 несколько превышает аналогичную связь в этилене (0,134 нм), а длина связи между С2 и С3 равна 0,146 нм, что значительно меньше простой углерод-углеродной связи в алканах (0,154 нм.).
Все атомы в бутадиене-1,3 располагаются в одной плоскости, а валентные углы равны 120о. π-Связи располагаются в плоскости, перпендикулярной плоскости расположения всех атомов. При таком расположении π-связей становится возможным частичное дополнительное перекрывание р-орбиталей при С-2 и С-3, что способствует «стягиванию» ядер атомов С-2 и С-3. (рис.2.15)
Рисунок 2.11. Перекрывание орбиталей в молекуле бутадиена -1,3
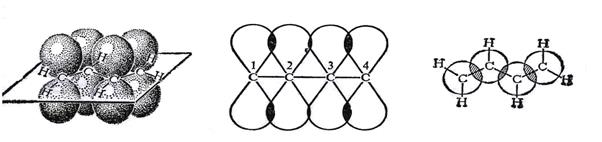
Таким образом, благодаря дополнительному перекрыванию р-орбиталей двух соседних π-связей происходит формирование единого π-электронного облака,как это показано ниже: (рис.2.12.)
Рисунок 2.12. Делокализованное π-электронное облако в бутадиене-1,3
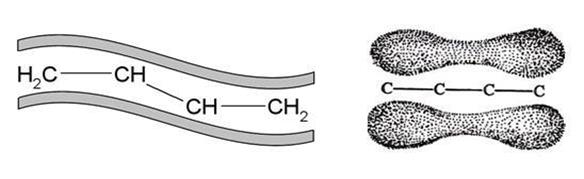
Следствием такого взаимодействия соседних π-связей является не только изменение длин связей, но и внутренней энергии молекулы: она существенно меньше (на~17 кДж/моль), чем следует ожидать при отсутствии дополнительного перекрывания.
Тип электронного взаимодействия, осуществляющийся в молекулах, ионах, радикалах, в структуре которых имеет место чередование σ- и π-связей, и приводящий к образованию единого делокализованногоπ-электронного облака, называется сопряжением.
Таким образом, благодаря сопряжению внутренняя энергия молекулы диена понижается, а её стабильность (устойчивость) повышается.
«Избыточная» энергия, которая высвобождается в результате сопряжения, называется энергией сопряжения (энергией делокализации).
Тип сопряжения, реализующийся за счёт дополнительного перекрывания орбиталей π-связей в молекулах с чередующимися простыми и кратными связями, называется π,π-сопряжением.
Другой разновидностью сопряжения является р,π-сопряжение, которое формируется путём взаимодействия π-орбитали кратной связи с р-АО атома или группы атомов, содержащих неподелённую пару электронов (рис. 2.13):
Рисунок 2.13. р,π-Сопряжение в молекуле с участием p-электронов заместителя и π-электронов кратной связи
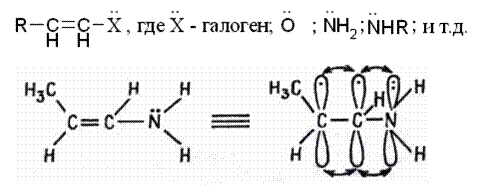
Различают ещё один тип сопряжения, который обозначается как σ, π-сопряжение (сверхсопряжение, гиперконъюгация). Наблюдается в соединениях, в которых алкильные группы связаны с системой сопряжённых связей, благодаря чему имеет место взаимодействие π-электронов кратной связи с σ-электронами С–Н связей:
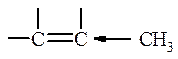
Бутадиен-1,3 и подобные ему соединения относятся к сопряжённым системам с открытой цепью.
Однако существует обширная группа сопряжённых систем с замкнутой цепью (карбоциклические и гетероциклические ароматические соединения).
2.7. Бензол как классический пример ароматического соединения
Термин «ароматические соединения», присвоенный в начале XIX столетия бензолу и его многочисленным производным, случаен по своему происхождению. Первыми известными веществами этого ряда (бензойный альдегид, бензойная кислота, толуол) были соединения, имеющие приятный запах. Их выделяли из ароматных бальзамов или других благовонных веществ природного происхождения. Родоначальник ароматических углеводородов – бензол С6Н6, для которого в 1865 г. Августом Кекуле впервые была предложена структура, позволившая объяснить свойства этого вещества.
Строение бензола. Ароматичность.В молекуле бензола все шесть атомов углерода находятся в sp2-гибридизованном состоянии (подробно см. этилен). За счёт трёх sp2-гибридных орбиталей каждый атом углерода связывается с двумя соседними атомами углерода и одним атомом водорода.
Соединяясь между собой, атомы углерода образуют плоский правильный шестиугольник с одинаковой длиной С–С-связей, равной 0,139 нм и валентным углом 120о. Негибридные pz-орбитали атомов углерода располагаются перпендикулярно плоскости шестичленного цикла. Каждая pz-орбиталь равномерно с обеих сторон перекрывается с такими же pz-орбиталями соседних атомов углерода, в результате чего формируется замкнутое π-электронное облако, что представлено ниже (2.14.):
Рисунок 2.14. Формирование единого π-электронного секстета в бензоле
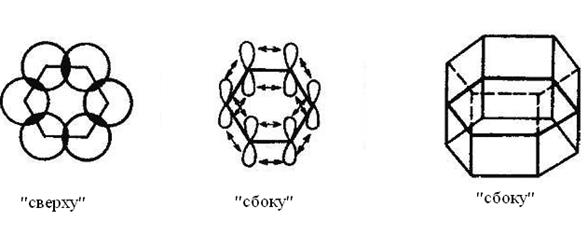
В отличие от алкенов у бензола электроны π-связей не заключены в областях между каждой парой атомов углерода, а равномерно распределены между шестью атомами углерода, т.е. делокализованы. Единое π-электронное облако расположено над и под плоскостью шестичленного цикла в виде двух «бубликов» (рис. 2.15.). Таким образом, строение бензола может быть представлено в виде структур:
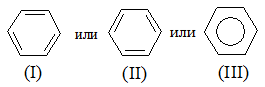
Структура (III) наиболее удовлетворительно отражает самую главную особенность – равномерность распределения π-электронов между атомами углерода. Однако структуры (I) и (II) (структуры Кекуле) ещё широко используют, поскольку они удобны при написании и объяснении механизмов реакций.
Рисунок 2.15. Молекула бензола: π-облака расположены над и под плоскостью цикла
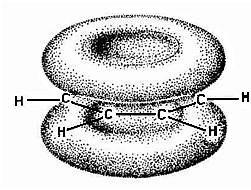
Бензол отличается от рассмотренных ранее углеводородов признаками, совокупность которых определяет так называемые ароматические свойства. Длина С–С-связей в бензоле есть нечто среднее между простой (0,154 нм) и этиленовой двойной (0,134 нм) связями. Атомы углерода образуют правильный плоский шестиугольник, в котором электронная плотность равномерно распределена между всеми атомами углерода.
В бензоле нет обычных двойных связей, а существует единое, делокализованное π-электронное облако.
Доказательством тому, что бензол не является циклическим гексатриеном может служить теплота гидрирования.
Известно, например, что теплота гидрирования циклогексена, в котором имеется одна двойная связь, равна 120,58 кДж/моль. Следовательно, если бы бензол был циклическим гексатриеном, то его теплота гидрирования должна была бы соответствовать 361,7 кДж/моль (120,58 кДж/моль × 3):
Реально же теплота гидрирования бензола составляет 208,5 кДж/моль, т.е. на 153,2 кДж/моль меньше, чем у гипотетического циклогексатриена. Такой выигрыш в энергии достигается благодаря делокализации (сопряжению). Из этого следует, что бензол характеризуется более высокой термодинамической стабильностью, чем можно было ожидать, и его энергия делокализации (энергия резонанса) составляет 153,2 кДж/моль.
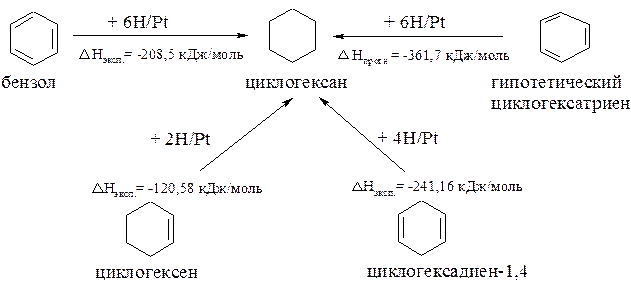
Используя квантово-химические расчёты Э. Хюккель установил, что при формировании замкнутых сопряжённых систем возможна циклическая делокализация π-электронов, следствием которой является повышение стабильности системы.
Правило Хюккеля утверждает, что повышенной термодинамической стабильностью характеризуются только такие моноциклические карбоциклы, которые являются плоскими и содержат в замкнутой системе (4n + 2) π-электронов, где n=0,1,2… Из этого следует, что в плоской моноциклической структуре единое делокализованное π-электронное облако должно содержать 2, 6, 10, 14 и т.д. π-электронов.
Заметим, что бензол отвечает всем критериям ароматичности, а 6 π-электроны бензольного ядра называют ароматическим π-секстетом.
Для плоских конденсированных систем – нафталина (10 π-электронов), антрацена, фенантрена (14 π-электронов) и т.д., в которых все атомы углерода находятся в состоянии sp2-гибридизации, также применимо правило Хюккеля.
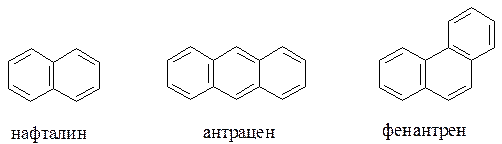
Следует отметить, что термодинамическая стабильность характерна и для трёх-, четырёх-, пяти-, семичленных сопряжённых систем, в которых число π-электронов соответствует правилу Хюккеля.
Это было показано на основании теоретических расчётов, а затем подтверждено экспериментально, когда подобные соединения были синтезированы.
Рассмотрим, например, циклопропен, в котором имеется два π-электрона, локализованные между двумя sp2-гибридными атомами углерода. Поскольку в этой же молекуле третий атом углерода – sp3-гибридизован, то делокализация π-электронов исключается и, следовательно, молекула неароматична.
В определённых условиях возможен отрыв гидрид-иона (Н:–) за счёт гетеролитического разрыва связи Сsp3-Н с образованием циклопропенил-катиона.

При разрыве связи Сsp3-Н атом углерода переходит в sp2-гибридное состояние и приобретает положительный заряд. У этого же атома после отщепления гидрид-иона остаётся незаполненная, вакантная р-орбиталь. В образовавшемся катионе все три С–С связи имеют одинаковую длину, а π-электроны делокализованы. Таким образом, циклопропенил-катион отвечает критериям ароматичности, т.е. содержит плоский цикл с делокализованными π-электронами.
В молекуле циклопентадиена-1,3 пятичленный цикл сформирован за счёт четырёх атомов Сsp2 и одного атома Сsp3. Соединение это не является ароматическим, поскольку отсутствует единое сопряжение с участием всех атомов углерода. Разрыв сопряжения происходит на атоме Сsp3. Однако, если осуществить гетеролитический разрыв одной из Сsp3-Н связей с отщеплением иона Н+ (протона), то образуется циклопентадиенильный анион, представляющий собой плоскую систему:

При этом Сsp3 переходит в Сsp2, р-орбиталь которого содержит пару электронов.Эта р-орбиталь располагается перпендикулярно плоскости цикла, поэтому перекрывается с р-орбиталями остальных четырёх атомов Сsp2:

Следствием такого взаимодействия, т.е. перекрывания р-орбиталей является формирование единого делокализованного 6π-электронного облака, распределенного между всеми пятью атомами в цикле. Отрицательный заряд также делокализован, что показано в виде кружка со знаком «-» внутри цикла. Данный анион соответствует правилу Хюккеля и обладает ароматическими свойствами.
В бензоле на шесть атомов в цикле приходится шесть π-электронов, а в циклопентадиенильном анионе – на пять атомов в цикле приходится 6π-электронов.
Бензол является π-эквивалентной системой, а циклопентадиенильный анион – π-избыточной.
Из приведённых примеров очевидно, что существуют соединения, которые не относятся к бензоидным (бензольным) структурам, но отвечают критериям ароматичности и, следовательно, обладают ароматическими свойствами.
Подобные системы принято называть небензоидными ароматическими соединениями.
По аналогичным причинам к ароматическим небензоидным соединениям относится циклогептатриенильный катион (тропилий-катион) и конденсированная система – азулен, содержащая пяти- и семичленный циклы.
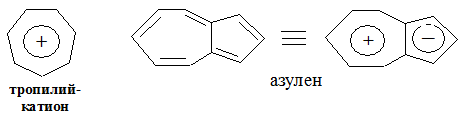
Катион тропилия следует относить к π-дефицитным системам, поскольку число π-электронов (шесть) здесь меньше, чем число атомов углерода в цикле (7).
Таким образом ароматические карбоциклические системы можно разделить на три типа: электронейтральные (бензол), анионоидные (циклопентадиенил-анион) и катионоидные (катион тропилия).
Дата добавления: 2020-10-01; просмотров: 791;











