Строение метана, этилена и ацетилена
В основном, невозбуждённом состоянии на внешней оболочке атома углерода имеется только два неспаренных электрона (-2s22p2). Для образования четырёх ковалентных связей необходимо наличие четырёх неспаренных электронов, что достигается переходом одного из двух 2s-электронов на вакантную р-орбиталь:

Переход атома углерода в возбужденное состояние сопровождается затратой энергии, которая в дальнейшем компенсируется при образовании химической связи.
Для атомов углерода в алканах характерна sp3-гибридизация, поэтому эти атомы соединяются между собой только σ-связью. Данный тип связи в алканах формируется в результате перекрывания sp3-гибридной орбитали одного атома углерода с sp3-гибридной орбиталью другого атома углерода.
Ось симметрии этой связи совпадает с прямой, соединяющей ядра атомов углерода. Между атомами углерода и водорода связь образуется в результате перекрывания s-орбитали водорода с sp3-гибридной орбиталью атома углерода.
На рисунке 2.3. показано формирование молекулы метана: sp3-гибридные орбитали направлены к вершинам тетраэдра.
Рисунок 2.3. Образование метана
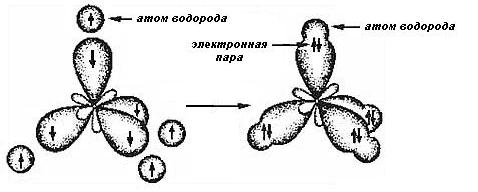
При таком расположении орбитали максимально удалены друг от друга. Чтобы перекрывание каждой из четырёх гибридных орбиталей с s-орбиталью водорода было наиболее эффективно и образовалась прочная связь, необходимо, чтобы ядро каждого атома водорода располагалось в вершине этого тетраэдра.
Из рисунка видно, что метан представляет собой правильный тетраэдр.
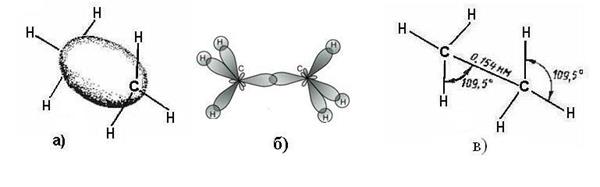
В этане (рис. 2.4.) длина углерод-углеродной связи С-С равна 0,154 нм, С-Н – связи – 0,110 нм, а валентный угол составляет 109,5°.
Таким образом, в предельных углеводородах между всеми атомами углерода содержатся простые связи, т.е. σ-связи.
Рисунок 2.4. Строение этана
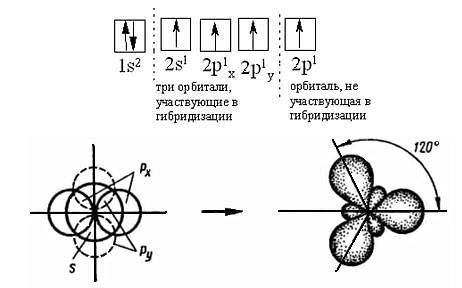
Отличительной особенностью строения этилена является двойная углерод-углеродная связь. Здесь атомы углерода находятся в sp2-гибридном состоянии. Это значит, что в гибридизации участвуют одна s- и две р-орбитали и у каждого атома углерода имеется три sp2-гибридные орбитали (рис. 2.5.), располагающиеся в одной плоскости под углом 120°. Не участвующая в гибридизации рz-орбиталь располагается перпендикулярно к плоскости трёх sp2-гибридных орбиталей:
Рисунок 2.5. sp2 – Гибридизация атомных орбиталей
В молекуле этилена каждый sp2-гибридизованный атом углерода образует три σ-связи – одну С-С и две С-Н. Негибридные pz-орбитали располагаются в одной плоскости и взаимодействуют друг с другом путём «бокового» перекрывания (рис. 2.6.). В результате такого «бокового» перекрывания образуется ещё одна связь (π-связь), которая располагается в плоскости, перпендикулярной σ-связи. Длина углерод-углеродной связи в этом случае составляет 0,134 нм.
Рисунок 2.6. Строение этилена
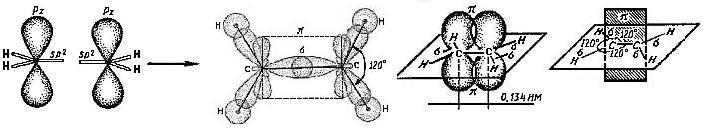
Таким образом, в молекуле этилена имеются пять σ-связей и одна π-связь.
Энергия разрыва простой углерод-углеродной связи составляет примерно 335 кДж/моль, а для двойной С=С-связи она равна 615 кДж/моль. Прочность π-связи составляет 615-335=280 кДж/моль). что значительно меньше, чем σ-связи (сравните 335 и 280 кДж/моль). Это объясняется тем, что связь, формирующаяся при «боковом» перекрывании (π-связь), менее прочная, чем при «лобовом» (σ-связь). Электроны, участвующие в π-связывании, слабее удерживаются ядрами углерода, поэтому поляризуемость этой связи гораздо выше, чем σ-связи. Облака π-электронов двойной связи располагаются над и под плоскостью σ-связи, что обеспечивает большую их доступность для атаки.
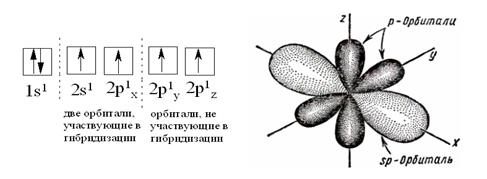
В ацетилене атомы углерода находятся в sp-гибридном состоянии. В гибридизации участвуют одна s- и одна р-орбитали.
У каждого атома углерода имеются две sp-гибридные орбитали, располагающиеся на одной прямой, т.е. под углом 180° и две негибридные р-орбитали, которые расположены перпендикулярно как к гибридным, так и по отношению друг к другу (рис. 2.7.).
Рисунок 2.7. sp – Гибридизация атомных орбиталей
 Две гибридизованные sp-орбитали (по одной от каждого атома углерода), перекрываясь, образуют σ-связь (осевое перекрывание).
Две гибридизованные sp-орбитали (по одной от каждого атома углерода), перекрываясь, образуют σ-связь (осевое перекрывание).
Оставшиеся у каждого атома углерода негибридизованные р-орбитали (2ру и 2рz), располагаются во взаимно перпендикулярных плоскостях и перекрываются соответственно с аналогичными орбиталями другого sp-гибридизованного углеродного атома, формируя две π-связи (боковое перекрывание). Каждая из этих π-связей располагается во взаимно перпендикулярных плоскостях как между собой, так и по отношению к σ-связи (рис. 2.8.) длина углерод-углеродной связи составляет 0,120 нм, валентные углы равны 180°, т.е. молекула ацетилена линейна.
Для описания химической связи используют такие методы квантовой механики, как метод молекулярных орбиталей, а также метод валентных связей (МВС)*.
Дата добавления: 2020-10-01; просмотров: 1132;











