Стереоспецифический гидролиз N-ацил -L-аминокислот под действием аминоацилазы или карбоксипепсидазы, приводящий к образованию L-аминокислот.
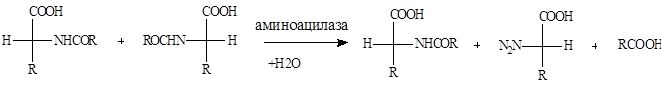
Принципы избирательного гидролиза аксиально или экваториально расположенной простой эфирной группы под действием ферментов лежит и в основе разделения рацемических смесей эфиров и терпенов.
Весьма перспективным представляется использование ферментов в качестве датчиков вредных и ядовитых веществ. Так, в качестве индикатора на фосфорорганические отравляющие вещества нервно-паралитического действия применяется холинэстераза. Ее так же возможно использовать и для определения многих пестицидов. Степень ингибирования этого фермента в присутствии ОВ или пестицидов оценивают электрохимическими или колориметрическими методами.
Аналогично карбонгидраза весьма чувствительна к хлорпроизводным алифатических, а гексокиназа – ароматических углеводородов.
Все большее развитие получают технологические процессы с участием сложных энзиматических систем, включающих коферменты. Так, созданы ферментные мембранные реакторы, катализирующие непрерывные процессы с регенерацией НАДН (восстановительное аминирование кетокислот, восстановление α - кетокислот в α - гидроксикислоты). Разработаны системы разделения рацематов посредством стереоспецифического активного транспорта. Например, мембрана, содержащая гексокиназу и фосфатазу, функционирует как насос, избирательно прокачивающий лишь D-глюкозу. Применение сопряженных ферментативных реакций с участием алкогольоксидазы, каталазы дрожжей Hansenulla polimorphaи формальдегиддисмутазы бактерии Pseudomonas putidaпозволило осуществить окисление метанола в муравьиную кислоту с выходом 88- 94%. В промышленности большое будущее имеют ферменты, способные катализировать химические реакции в органической фазе (“каталитические антитела”), в частности липазы. Существенно, что каталитическая активность панкреатической липазы свиньи сохраняется при концентрации воды в реакционной среде, составляющей всего 0,015 %, и при температуре 100 °С. Препараты липазы используют для синтеза оптически чистых сложных эфиров и феромонов, применяющихся в парфюмерии и медицине.
Для деградации и модификации антропогенных органических соединений, поступающих в окружающую среду, используют ферменты разных классов и в том числе лакказу, лигниназу, тирозиназу, монооксигеназу, диоксигеназу и др. Перспективна для очистки сточных вод новая технология, основанная на использовании реакции пластеинообразования, открытой А. Я. Данилевским в 1886 году. Сущность работ Данилевского состоит в экспериментальном доказательстве обращения протеолиза и возможности синтеза белковоподобных веществ (пластеинов) под действием ряда протеолитических ферментов. Сточные воды содержат аминокислоты и пептиды, концентрация которых возрастает в результате гидролиза белковых компонентов отходов под воздействием пептидогидролаз микроорганизмов. Данная технология, активно внедряющаяся во
Франции, нацелена на производство в промышленных масштабах кормовых белков из аминокислот и пептидов сточных вод.
Развитие клеточной и генной инженерии было бы невозможно, если бы в распоряжении исследователей не было целого набора специфических ферментов (рестриктаз, лигаз, синтетаз, ферментов избирательно разрушающих клеточную оболочку и др.). Так, в настоящее время в продаже имеется более 300 различных рестриктаз.
Ферменты широко используют в медицине, например в заместительной терапии в составе лечебных препаратов. Пероральное введение фенилаланин-аммиак-лиазы снижает уровень фенилаланина в крови при фенилкетонурии. Протеолитические ферменты, амилазу и липазу применяют при заболеваниях желудочно-кишечного тракта и печени. В последние годы накопились данные об эффективности применения протеиназ в энзимотерапии злокачественных новообразований. Это объясняется большей проницаемостью мембран раковых клеток для гидролитических ферментов в сравнении с нормальными клетками, благодаря чему опухолевые клетки быстро лизируются при введении смеси протеиназ (препарат «папайотин»). Протеолитические ферменты - плазмин иактивирующие его стрептокиназу и урокиназу используют для растворения тромбов в кровеносных сосудах и разжижении гноя; коллагеназу - для рассасывания рубцовых образований; эластазу - для задержки развития атеросклероза; лизоцим - для лечения конъюнктивитов; дезоксирибонуклеазу из стрептококка (стрептодорназа) - для лечения заболеваний верхних дыхательных путей и роговицы глаза.
L-аспарагиназупродуцируют Е. coli и Erwinia carotovora. Фермент используют при химиотерапии некоторых форм лейкемии. L-аспарагиназа отщепляет одну аминогруппу от аспарагина, превращая его в аспарагиновую кислоту. Избирательность действия фермента определяется потребностью некоторых форм опухолевых клеток в аспарагине, тогда как нормальные клетки в аспарагине не нуждаются.
Нейраминидазу получают при культивировании Vibrio cholera. Фермент отщепляет остатки N-ацетилнейраминовой кислоты, входящей в мембрану некоторых опухолевых клеток, повышая таким образом их антигенную активность. Может быть использован при лечении некоторых форм лейкемии.
β-лактамазы, инактивирующие пенициллины и цефалоспорины, используются при определении стерильности этих антибиотиков (см. ниже) или при микробиологическом анализе клинического материала от больных, получающих эти антибиотики. В терапевтических целях их используют в случае тяжелой аллергической реакции на β-лактамные антибиотики. Фермент вводят внутримышечно или внутривенно совместно с другими препаратами (адреналин, антигистаминные средства).
Важнейшую область применения ферментов в медицине составляет энзимодиагностика - тестирование патологии того или того органа человека по уровню активности фермента или соотношению его множественных форм и изоферментов. Так, аспартатаминотрансфераза, изоцитратдегидрогеназа, лактатдегидрогеназа: альдолаза служат для выявления инфаркта миокарда; аланинаминотрансфераза, аспартатаминотрансфераза и лактатдегидрогеаза - для диагностики заболеваний печени; глутамилтрансфера-1 - для блокировки отторжения органов при их пересадке и т.д. Таким образом, производство ферментных препаратов занимает одно из ведущих мест в современной биотехнологии и относится к тем ее отраслям, объем продукции, которых постоянно растет, а сфера применения неуклонно расширяется. По объему производства ферментов доминируют страны Западной Европы (фирма “Ново Индастри”, Дания), резкий рост этой индустрии наблюдается в США и Японии.
РИБОЗИМЫ.
До начала 80-х годов ХХ века основополагающей аксиомой биохимии было утверждение, что все метаболитические реакции происходят с надлежащими для обеспечения жизни скоростями только благодаря высокоэффективным специфическим катализаторам белковой природы - ферментам или энзимам.
Однако в 1981-1982 г. группой американских биохимиков во главе с Т.Чехом было обнаружено, что в природе имеются виды РНК, которые, подобно белкам, обладают высокоспецифической каталитической активностью. Их субстратсвязывающий домен присоединяется к комплементарному участку РНК-мишени с помощью водородных и, возможно, других связей, а каталитический расщепляет ее в специфическом сайте. Такие РНК-катализаторы были названы рибозимами.
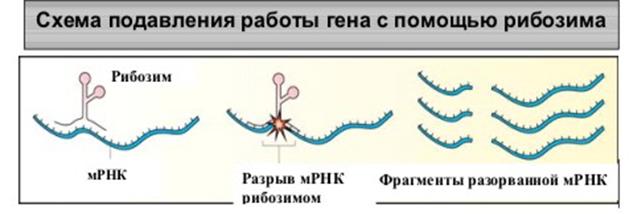 |
Открытие рибозимов имело огромное теоретическое и практическое значение для биохимии, молекулярной биологии и биотехнологии.
Во-первых, был положен конец представлению об исключительной роли белков в катализе биохимических реакций. В настоящее время установлено, что рибозимы играют важнейшую роль в процессах синтеза и превращения РНК, например в процессах сплайсингау эукариот и способны осуществлять практически весь спектр ферментативных реакций (рестрикция, сшивка, трансформации и др.). В настоящее время рибосому тоже принято рассматривать как рибозим. Действительно, все имеющиеся экспериментальные данные свидетельствуют о том, что синтез полипептидной цепи белка в рибосоме катализируется рибосомной РНК, а не рибосомными белками. Идентифицирован каталитический участок большой рибосомной РНК, ответственный за катализ реакции транспептидации, посредством которой осуществляется наращивание полипептидной цепи белка в процессе трансляции.
Во-вторых, это позволило существенно пересмотреть взгляды на механизмы возникновения жизни и на ранние этапы эволюции. В частности в последнее время активно обсуждается гипотеза “Мира РНК”, как противовес классической теории академика А.И. Опарина. В частности гипотеза “Мира РНК” позволяет решить проблему, на которую долго закрывали глаза практически все ученые - сторонники теории академика А.И. Опарина, а именно, каким образом случайно получившиеся, единичные, удачные белковые молекулы могли копироваться и воспроизводиться в коацерватной капле, а тем более передаваться коацерватам – потомкам.
Накопление знаний о генетическом коде, нуклеиновых кислотах и биосинтезе белков привело к утверждению принципиально новой идеи о том, что все начиналось вовсе не с белков, а с РНК. Нуклеиновые кислоты являются единственным типом биологических полимеров, макромолекулярная структура которых, благодаря принципу комплементарности при синтезе новых цепей, обеспечивает возможность копирования собственной линейной последова-тельности мономерных звеньев, другими словами, возможность воспроизведения (репликации) полимера, его микроструктуры. Поэтому только нуклеиновые кислоты, но не белки, могут быть генетическим материалом, то есть воспроизводимыми молекулами, повторяющими свою специфическую микро-структуру в поколениях.
По ряду соображений именно РНК, а не ДНК, могла представлять собой первичный генетический материал.
Во-первых, и в химическом синтезе, и в биохимических реакциях рибонуклеотиды предшествуют дезоксирибонуклеотидам; дезоксирибонуклеотиды - продукты модифи-кации рибонуклеотидов.
Во-вторых, в самых древних, универсальных процессах жизненного метаболизма широко представлены именно рибонуклеотиды, а не дезоксирибонуклеотиды, включая основные энергетические носители типа рибонуклеозид-полифосфатов (АТФ и т.п.).
В-третьих, репликация РНК может происходить без какого бы то ни было участия ДНК, а механизм редупликации ДНК даже в современном живом мире требует обязательного участия РНК-затравки в инициации синтеза цепи ДНК.
В-четвертых, обладая всеми теми же матричными и генетическими функциями, что и ДНК, РНК способна также к выполнению ряда функций, присущих белкам, включая катализ химических реакций. Таким образом, имеются все основания рассматривать ДНК как более позднее эволюционное приобретение - как модификацию РНК, специализированную для выполнения функции воспроизведения и хранения уникальных копий генов в составе клеточного генома без непосредственного участия в биосинтезе белков.
После того как были открыты каталитически активные РНК, идея первичности РНК в происхождении жизни получила сильнейший толчок к развитию, и была сформулирована концепция самодостаточного мира РНК,предшествовавшего современной жизни. Возможная схема возникновения “Мира РНК” представлена на рис.2.
Абиогенный синтез рибонуклеотидов и их ковалентное объединение в олигомеры и полимеры типа РНК могли происходить приблизительно в тех же условиях и в той же химической обстановке, что постулировались для образования аминокислот и полипептидов. Недавно российскими учеными (Институт белка РАН) было экспериментально показано, что, по крайней мере, некоторые полирибонуклеотиды (РНК) в обычной водной среде способны к спонтанной рекомбинации, то есть обмену отрезками цепи, путем транс-эстерификации. Обмен коротких отрезков цепи на длинные, должен приводить к удлинению полирибонуклеотидов (РНК), а сама подобная рекомбинация способствовать структурному многообразию этих молекул. Среди них могли возникать и каталитически активные молекулы РНК. Даже крайне редкое появление единичных молекул РНК, которые были способны катализировать полимеризацию рибонуклеотидов или соединение (сплайсинг) олигонуклеотидов на комплементарной цепи как на матрице, означало становление механизма репликации РНК. Репликация самих РНК-катализаторов (рибозимов) должна была повлечь за собой возникновение самореплицирующихся популяций РНК. Продуцируя свои копии, РНК размножались. Неизбежные ошибки в копировании (мутации) и рекомбинации в самореплицирующихся популяциях РНК создавали все большее разнообразие этого мира. Таким образом, предполагаемый древний мир РНК - это самодостаточный биологический мир, в котором молекулы РНК функционировали и как генетический материал, и как энзимоподобные катализаторы.
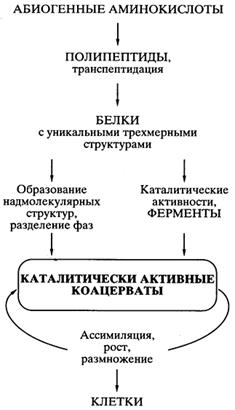
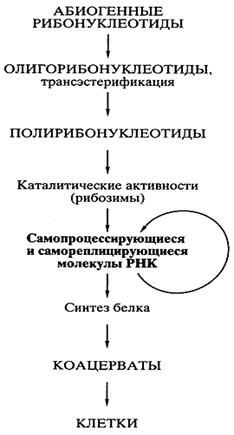
Рис. 2 гипотеза А.И. Опарина гипотеза ”Мир РНК”
В настоящее время в природе известно только восемь рибозимов, обладающих достаточно низкой каталитической активностью по сравнению с белковыми катализаторами. Возможно раньше, рибозимов было гораздо больше, и они обеспечивали все многообразие необходимых для биосинтеза реакций, а затем они исчезли в процессе эволюционного отбора наиболее эффективных способов хранения и обработки наследственной информации. Что касается низкой эффективности катализа рибозимами, то у эволюции, было, достаточно времени и ее начальные стадии могли проходить очень медленно.
В последнее время в лабораториях разных стран проводятся работы по искусственному синтезу различных рибозимов. Наибольших успехов достигла группа во главе с Д. Бартелом. Используя разработанную ими селекс-технологию (метод эволюции искусственного мира РНК в пробирке) они синтезировали 65 новых рибозимов и сумели повысить их активность в десятки и сотни раз.
В третьих,рибозимы могут использоваться как высокоэффективные лекарственные препараты направленного действия для генной терапии. В большинстве методов генной терапии ех vivo и in vivo используются клонированные генетические конструкции, возмещающие функциональную форму белка, который не синтезируется в организме больного или синтезируется в дефектной форме. Однако многие заболевания человека (рак, воспаления, вирусные и паразитарные инфекции) связаны, напротив, с гиперпродукцией нормального белка. Для лечения таких состояний разработаны терапевтические
системы с использованием олигонуклеотидов. Небольшой олигонуклеотид может либо гибридизоваться со специфическим геном или мРНК и снижать уровень транскрипции или трансляции, уменьшая тем самым количество синтезируемого белка, ответственного за патологию (“антигенные” или “антисмысловые” нуклеотиды) либо разрушать их (дезоксирибозим или рибозим).
Создание «терапевтического» рибозима - сложный процесс. Связано это с трудностью получения больших количеств синтетических РНК и сохранения их в нативном состоянии в клетке-мишени. Модифицируя субстрат - связывающую последовательность нуклеотидов с помощью методов генной инженерии, получают рибозимы, расщепляющие специфические мРНК и подавляющие трансляцию белка, ответственного за развитие того или иного заболевания. Рибозимы, созданные методами генной инженерии, можно использовать для лечения рака и вирусных инфекций.
Природных ДНК-ферментов (дезоксирибозимов) пока не обнаружено, но уже синтезированы олигодезоксинуклеотиды, обладающие каталитической активностью. Преимущество дезоксирибозимов состоит в том, что для их получения не нужно использовать экспрессирующий вектор: ДНК-ферменты можно просто упаковать в липосомы и доставить в клетку-мишень. Однако создание эффективных ДНК-ферментов находится пока на начальном этапе развития.
Дата добавления: 2020-10-01; просмотров: 570;











