Вопрос 60. Строение двойного электрического слоя. Уравнение Нернста.
Возникновение электродного потенциала, двойной электрический слой.
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. Абсолютные значения электродных потенциалов экспериментально определить невозможно. Однако можно определить разность электродных потенциалов. Поэтому для характеристики электродных процессов пользуются относительными значениями электродных потенциалов. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого условно принимают равным нулю. Двойной электрический слой - два весьма близких друг к другу слоя электрических зарядов разного знака, но с одинаковой поверхностной плотностью, возникающие на границе раздела двух фаз. Д. э. с. в целом электронейтрален. При пересечении Д. э. с. электрический потенциал изменяется скачком. Д. э. с. на поверхности металла возникает из-за того, что электроны металла несколько выходят за пределы решётки, образованной положительными ионами. Скачок потенциала в таком Д. э. с. является составной частью работы выхода электрона из металла. Для электрохимии большое значение имеет Д. э. с. на границе раздела металл - электролит. При погружении металла в раствор, содержащий ионы этого металла, образуется специфический для границы электрод - раствор ионный Д. э. с. дополнительно к Д.э.с., существовавшему на поверхности металла до погружения, и Д. э. с., возникающему в результате ориентации полярных молекул растворителя (например, воды) у поверхности металла. Так, при погружении серебряной пластинки в раствор KNO3 , содержащий очень мало AgNO3, ионы Ag+ переходят из металла в раствор, избыточные электроны в металле заряжают его поверхность отрицательно и притягивают из раствора ионы К+, образующие у поверхности вторую (положительную) обкладку Д. э. с. (см. рис.). Возникающий скачок потенциала приостанавливает дальнейший переход ионов Ag+, и наступает равновесие электрода с раствором. Если концентрация AgNO3 в растворе велика, то, наоборот, ионы Ag+ из раствора переходят в металл, его поверхность заряжается положительно и притягивает из раствора ионы NO3 Существует промежуточная концентрация ионов металла, при которой поверхность металла не заряжается; соответствующий потенциал электрода называется потенциалом нулевого заряда, или нулевой точкой. Важное понятие о нулевой точке как величине, характерной для данного электрода, введено в электрохимию советским учёным А. Н. Фрумкиным.
На ноны в Д. э. с. действуют одновременно электростатические силы и силы теплового движения. В результате взаимно противоположного влияния этих сил лишь часть ионов остаётся непосредственно вблизи поверхности электрода (плотная часть Д. э. с., или слой Гельмгольца), а остальные распределяются диффузно в растворе на некотором расстоянии от электрода (диффузный Д. э. с., или слой Гуи). Степень диффузности увеличивается с ростом температуры, а также при уменьшении концентрации раствора электролита и при уменьшении заряда электрода. Средняя толщина плотной части Д. э. с. порядка радиуса иона (несколько А), поэтому Д. э. с. обладает высокой электрической ёмкостью (~10-5ф/см2) и внутри него действует сильное электрическое поле (~106 в/см). Строение Д. э. с. оказывает большое влияние на электрические свойства межфазных границ и на протекающие на них процессы - прежде всего, на механизм и кинетику электрохимических реакций, на электрокинетические явления, на устойчивость коллоидных систем и т. п. Для исследования Д. э. с. используются методы измерения поверхностного натяжения и ёмкости, адсорбционные измерения и др.
Для гальванического элемента (–)Pt, H2¦2H+||Mn+¦M(+), в котором протекает окислительно- восстановительная реакция 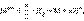 запишем уравнение изотермы
запишем уравнение изотермы 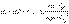 Учитывая, что для стандартного водородного электрода активности ионов H+ и газа H2 равны 1, а ΔG = –nFE, после преобразования получим уравнение Нернста для электродного процесса:
Учитывая, что для стандартного водородного электрода активности ионов H+ и газа H2 равны 1, а ΔG = –nFE, после преобразования получим уравнение Нернста для электродного процесса: 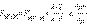
В этом уравнении 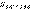 – ЭДС реакции, n – число электронов, участвующих в электронной реакции, F – число Фарадея. Уравнение (7.1) выражает зависимость электродного потенциала от концентрации (активности) ионов и температуры и называется уравнением Нернста для отдельного электрода. Отметив, что
– ЭДС реакции, n – число электронов, участвующих в электронной реакции, F – число Фарадея. Уравнение (7.1) выражает зависимость электродного потенциала от концентрации (активности) ионов и температуры и называется уравнением Нернста для отдельного электрода. Отметив, что 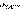 – активность окисленной формы реагента (оф), aM – активность его восстановленной формы (вф), уравнение Нернста можно записать в следующем виде:
– активность окисленной формы реагента (оф), aM – активность его восстановленной формы (вф), уравнение Нернста можно записать в следующем виде: 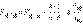 Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, получим удобную для расчетов форму уравнения Нернста:
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, получим удобную для расчетов форму уравнения Нернста:  Активность твердого вещества (aтв) принимается равной единице, поэтому в случае рассматриваемого нами
Активность твердого вещества (aтв) принимается равной единице, поэтому в случае рассматриваемого нами 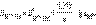 металлического электрода (aM) уравнение Нернста упрощается:
металлического электрода (aM) уравнение Нернста упрощается:
Дата добавления: 2016-07-18; просмотров: 1746;











