Детекторы для непрерывного контроля характеристик популяции клеток
К сожалению, в настоящее время имеется очень ограниченное число приборов, предназначенных для непрерывного контроля за поведением популяции клеток в биореакторе. Чаще всего возникает потребность в определении содержания или концентрации биомассы или, что еще важнее, концентрации активной биомассы. Существует несколько принципиально-возможных подходов к определению этих параметров, однако надежный и достаточно универсальный метод, применимый к самым различным организмам и средам, пока что не разработан.
Широко изучались оптические методы, основанные на измерении поглощения света (спектрофотометрические методы) или рассеяния света (нефелометрические методы, определение коэффициента отражения).
Можно, например, непрерывно пропускать поток культуры через ячейку спектрофотометра, но в этом случае возникают затруднения, связанные с нелинейным характером зависимости оптической плотности от концентрации биомассы, если последняя превышает 0,5 г/л или если оптическая плотность превышает 0,5. Следовательно, более концентрированные культуры можно изучать, разбавив изучаемую пробу или уменьшив длину пути светового луча.
На рис. 5 приведена схема проточной кюветы, разработанной Лимом и сотрудниками; такая конструкция кюветы хорошо зарекомендовала себя в ряде лабораторий. Предлагались также принципиально иные аналитические устройства, в которых оптическая плотность культуры определяется с помощью зондов, погружаемых в изучаемую культуральную жидкость.
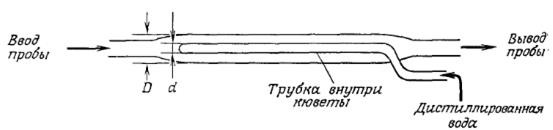
РИС. 5. Схема проточной кюветы с внутренним разведением, для чего внутри кюветы имеется трубка, заполненная дистиллированной водой. При диаметре кюветы D=12 мм и диаметре трубки d=8 мм это устройство обеспечивает линейную зависимость оптической плотности при 600 нм от концентрации клеток, даже если величина последней превышает 1,8 г/л. [Из статьи; Lee С., Lim Н., New Device of Continuously Monitoring the Optical Density of Concentrated Microbial Cultures; Biotech. Bioeng., 22, 636 (1980).]
Единственным методом, пригодным для непрерывного контроля биохимического или метаболического состояния популяции клеток непосредственно в реакторе, является флуорометрия. В этом методе культуральную жидкость облучают ультрафиолетовым светом с длиной волны 366 нм. Это излучение вызывает флуоресценцию восстановленных пиридиновых нуклеотидов (NADH и NADPH), причем максимальная интенсивность·флуоресценции наблюдается приблизительно при 460 нм. Флуоресценцию культуры измеряют соответствующим детектором, например фотодиодом или фотоумножителем. Первоначально такие измерения проводили через кварцевые окна, вмонтированные в стенки лабораторных ферментеров. Создание флуоресцентных зондов, которые могут быть установлены в реакторах так же, как и электроды, должно существенно расширить область применения флуорометрических методов в биотехнологии (рис. 6).
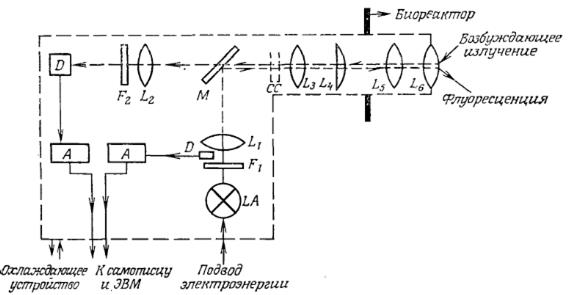
РИС. 6. Принципиальная схема зонда для непосредственного изучения флуоресценции культуральной жидкости. [Воспроизведено с разрешения из работы; Веуеіег W., Einsele А., Fiechter А., On-Line Measurements of Culture Fluorescence: Method and Application, European J. Appl. Microbiol. Biotechnol., 13, 10 (1981).]
 A — усилители; LA — источник УФ-излучения; D — фотоприемник; F1 — фильтр, пропускающий коротковолновое УФ-излучение (336 нм); F2 — фильтр, пропускающий излучение с длиной волны 450 нм; L1-6 — линзы; СС — градуировочная кювета; М — дихроичное зеркало, пропускающее излучение с длиной волны 460 нм и отражающее излучение с длиной волны 366 нм.
A — усилители; LA — источник УФ-излучения; D — фотоприемник; F1 — фильтр, пропускающий коротковолновое УФ-излучение (336 нм); F2 — фильтр, пропускающий излучение с длиной волны 450 нм; L1-6 — линзы; СС — градуировочная кювета; М — дихроичное зеркало, пропускающее излучение с длиной волны 460 нм и отражающее излучение с длиной волны 366 нм.
РИС. 7. Изменение флуоресценции системы после импульсного добавления раствора хинина в 0,5 М H2SO4 (результаты характеризуют процесс выравнивания концентрации растворенного вещества) (а) и после добавления глюкозы к культуре дрожжей (результаты характеризуют как процесс выравнивания концентраций, как и утилизацию глюкозы клетками) (б). [Воспроизведено с разрешения из статьи; Einsele А., Ristroph D. L., Humphrey А. Е., Mixing Times and Glucose Uptake Measured with a Fluorometer; Biotech. Bioeng., 20, 1487 (1978).]
Интенсивность флуоресценции зависит от плотности популяции клеток, среднего состояния метаболической активности и эмиссии флуоресценции, а также от поглощения света средой. Эксперименты в свободной от нерастворимых частиц среде показали, что изучение флуоресценции культуры дает полезную информацию о концентрации биомассы, переносе кислорода, а также о времени выравнивания концентраций, истощении субстрата и изменении характера метаболизма. Так, Айнзеле и сотрудники изучали динамику перемешивания жидкости в ферментере рабочим объемом 40 л с механическим перемешиванием (при скорости вращения мешалки 200 об/мин) в сравнении с динамикой перемешивания в том же реакторе при условии, что в нем находится культура дрожжевых клеток в глюкозной среде.
В первом эксперименте в раствор, содержащий 0,05 М H2SO4, в импульсном режиме вводили порцию хинина и затем измеряли флуоресценцию (хинин имеет примерно такой же спектр флуоресценции, что и NADH). Результаты этого эксперимента представлены на рис. 7, а, где виден колебательный характер изменений концентрации индикатора (хинина), отражающий структуру циркуляции жидкости в реакторе и показывающий, что новое стационарное состояние в реакторе достигается только после довольно продолжительного переходного периода. На рис 7, б представлены результаты изучения флуоресценции восстановленных пиридиновых нуклеотидов в культуре дрожжей после введения глюкозы (при t=0). Во втором эксперименте время отклика системы больше, что свидетельствует о существенном динамическом запаздывании процесса утилизации глюкозы клетками. О необходимости учета подобных эффектов при операциях масштабного перехода.
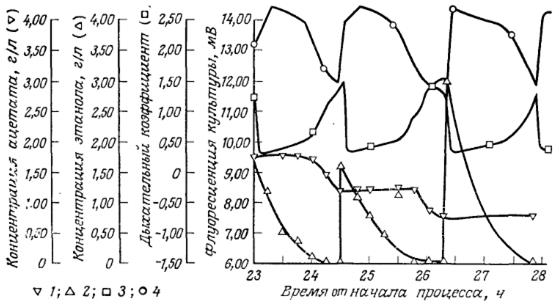
РИС. 8. Взаимосвязь между флуоресценцией культуры (4), концентрацией этанола (2), дыхательным коэффициентом (3) и концентрацией ацетата (1) в культуре С. utilis при периодическом добавлении субстрата (этанола). [Воспроизведено с разрешения из статьи: Watteeuw С. М., Armiger W. В., Ristroph D. L., Humphrey A. E., Production of Single Cell Protein from Ethanol by a Fed-Batch Process; Biotech. Bioeng., 21, 1221 (1979).]
Другой областью применения флуорометрического метода в биотехнологии является контроль метаболического состояния клеток в культуре, отражающего ход ферментации. При экспериментальном изучении роста культуры Candida utilis на этаноле в периодическом процессе с добавлением субстрата с помощью флуорометрии определяли время истощения субстрата (этанола) и контролировали добавление свежих порций этанола к системе. На рис. 8 представлены зависимости флуоресценции культуры, дыхательного коэффициента и концентрации этанола от времени в этом процессе. Кружками выделена кривая флуоресценции культуры, найденная при непрерывном контроле этого параметра. В представленной на этом рисунке части эксперимента в систему импульсно вводили 1,85, 1,85 и 3 г/л этанола спустя 23, 24,5 и 26,15 ч после начала процесса. Очевидно, что истощение субстрата (этанола) сопровождается снижением интенсивности флуоресценции.
На результаты непосредственного измерения оптических свойств культур клеток может влиять ряд факторов. Так, поверхности оптических приборов, находящиеся в контакте с культуральной жидкостью, могут загрязняться клетками или компонентами среды. Проведению измерений в многофазных системах могут мешать газовые пузырьки или частицы нерастворимых веществ. Что касается самого флуорометрического метода, то ряд компонентов среды или продуктов процесса может флуоресцировать при длинах волн, используемых для контроля состояния клеток, что, очевидно, затрудняет интерпретацию результатов измерений. Тем не менее надо полагать, что флуорометрические и другие оптические методы в будущем найдут гораздо более широкое применение, поскольку концентрация биомассы и метаболическая активность клеток являются ключевыми параметрами в контроле, регулировании и оптимизации микробиологических процессов.
В следующем разделе рассматриваются некоторые автономные, периодические методы изучения поведения клеток и свойств среды, играющих важную роль в биотехнологических процессах. Следует отметить, что между непрерывными методами мониторинга (осуществляемыми обычно с помощью встроенных в реактор или другой аппарат детекторов) и периодическими, автономными методами измерения нет четкой границы. Если время между последовательными анализами с помощью автономного аналитического прибора меньше характерного масштаба времени изменений определяемого параметра, то периодический отбор проб с некоторым запаздыванием во времени и их последующий анализ дадут точно такую же информацию, как и непрерывные измерения изучаемой системы в процессе работы (в реальном масштабе времени). Поскольку масштабы времени изменений свойств ферментов, культур клеток и жидкой фазы могут варьировать от нескольких минут до нескольких часов и даже дней, то некоторые автономные методы анализа с предварительным отбором проб дают денную для контроля и регулирования процесса информацию.
Дата добавления: 2020-10-01; просмотров: 645;











