Культивирование растительных клеток
Растительные ткани, выделенные из внутренних частей органов растений, после промывки и дезинфекции можно культивировать на агаре в соответствующей питательной среде.
Питательная среда для растительных клеток обычно состоит из смеси неорганических солей и глюкозы или сахарозы в качестве источника энергии и углерода. (В культуре растительные клетки обычно являются хемогетеротрофами, а не фотоаутотрофами.) В среду указанного выше состава обычно вводят также регуляторы роста растений, фитогормоны, витамины, аминокислоты и многоосновный спирт инозит. В такой культуре деление клеток осуществляется только в присутствии кислорода, поэтому ее следует аэрировать путем диффузии через свободную поверхность жидкости или посредством барботажа. Увеличение численности популяции в периодическом процессе подчиняется обычным закономерностям клеточного роста, но здесь обычно удается добиться только трех- или четырехкратного удвоения популяции, что соответствует увеличению клеточной массы в 10—15 раз по сравнению с массой посевного материала.
Культуры растительных тканей могут быть полезными при решении многих задач. Так, ферментные и метаболические системы растений можно использовать для проведения как сравнительно простых, так и очень сложных биохимических превращений. Примером таких реакций может служить получение дигоксина (важного стимулятора сердечной деятельности) из дигитоксина путем введения гидроксильной группы в 12β-положение последнего с помощью клеток наперстянки (Digitalis). Растительные клетки можно также использовать в биосинтезе сложных соединений из сравнительно простых предшественников; в частности, культуры растительных тканей способны осуществлять полный синтез сложных веществ, обычно вторичных метаболитов, из простых компонентов среды. К числу вторичных растительных метаболитов, представляющих интерес с точки зрения их промышленного производства, относятся фармацевтические препараты (в настоящее время около одной четверти всех разрешенных к применению в США лекарственных препаратов имеют растительное происхождение), красители (например, шиконин), камеди, природные инсектициды группы пиретринов, вкусовые вещества, а также пряности и душистые вещества типа продуцируемых ванилью и жасмином. Культуры растительных тканей, кроме того, служат ценным инструментом в генной инженерии растений: с их помощью можно существенно повысить урожайность, а в будущем возможно добиться выращивания целых растений хлебных злаков из культуры клеток. По сравнению с обычным методом выращивания растений в грунте и последующего сбора урожая культуры растительных тканей могут обеспечить более высокую продуктивность, надежность и предсказуемость урожая.
В суспензионной культуре растительные клетки находятся в изолированном состоянии или в виде крупных скоплений. Отмечалось, что в скоплениях растительные клетки в некоторой степени дифференцированы так, что клетки, находящиеся на наружной поверхности и внутри скопления, морфологически различны. В некоторых случаях необходимый продукт метаболизма вообще не синтезируется отдельными клетками, а только их скоплениями. Отсюда следует, что при определенных обстоятельствах некоторая степень дифференциации клеток способствует реализации тех путей метаболизма, в которых синтезируется необходимое вещество. В других случаях предпочтительнее недифференцированное состояние клеток в культуре. Дальнейшее практическое развитие этой области биотехнологии требует более глубокого изучения процессов регуляции дифференциации клеток, обусловленных дифференциацией эффектов, и возможности управления дифференциацией в культурах клеток путем изменения условий роста.
О кинетике роста растительных клеток в культуре опубликовано мало данных. Одно из немногих исключений представляют результаты работ Уилсона и сотрудников по изучению культивирования растительных клеток в хемостате. В табл. 15 приведены найденные этими исследователями экономические коэффициенты и время удвоения для культур растительных клеток двух типов при росте в средах с различными лимитирующими питательными веществами.
Таблица 15. Время удвоения и экономические коэффициенты для культур растительных клеток
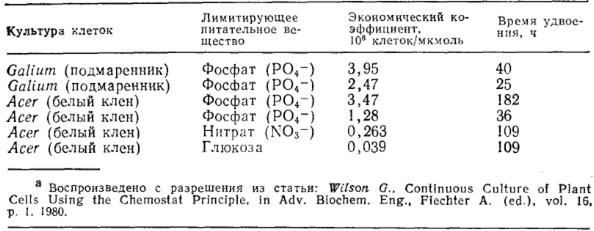
Обратите внимание на чрезвычайно большое время удвоения популяции, что является одним из основных препятствий как в экспериментальном изучении культур растительных клеток, так и в их промышленном применении в качестве катализаторов. Оценка константы насыщения Ks (или константы Моно) показала, что в случае роста культуры клеток Acer (клена белого) на лимитирующих субстратах (нитрате, глюкозе и фосфате) величина Ks составляет 0,13, 0,5 и 0,032 мМ соответственно.
Рост культур растительных клеток осуществляли не только во встряхиваемых сосудах, но и в реакторах с механическим перемешиванием, а также в реакторах колонного типа с барботажем. Для того чтобы повысить объемную плотность клеток в культуре, обеспечить возможность повторного их использования и сохранить в определенной стадии морфологического развития и дифференциации, а также для лучшего регулирования контакта между средой и клетками, несколько исследовательских групп изучали реакторы с иммобилизованными растительными клетками. В частности, исследовалось включение растительных клеток в полупроницаемые полые волокна, гранулы альгинатного геля и другие гранулированные носители. Многие продукты метаболизма растений накапливаются только внутри клеток, что может затруднять осуществление промышленных процессов с участием иммобилизованных клеток. Для решения этой проблемы предлагалось попеременно изменять проницаемость клеточных стенок путем изменения состава среды, чтобы одна среда обеспечивала рост клеток, а другая образование и секрецию продукта метаболизма.
Как мы уже отмечали при изучении способов производства вторичных метаболитов с помощью периодических культур микроорганизмов, в этом случае необходимо разделять во времени или в объеме фазу роста клеток и фазу образования вторичного метаболита. Такой подход был осуществлен и в первом промышленном крупномасштабном процессе с участием культуры растительных клеток, разработанном компанией Mitsui Petrochemical Industries. В этом процессе, включающем три последовательные операции общей продолжительностью более трех не  дель, в культуре Lithospermum erythrorhizon получают ценный краситель и фармацевтический препарат шиконин (рис. 46).
дель, в культуре Lithospermum erythrorhizon получают ценный краситель и фармацевтический препарат шиконин (рис. 46).
РИС. 46. Схема установки для производства вторичного метаболита шиконина с помощью культуры клеток растений (Lithospermum erthrorhizon). (Воспроизведено с разрешения из работы; Curtin М. Е., Harvesting Profitable Products from Plant Tissue Culture; Bio/Technology, October, 1983, p. 649.)
Клетки сначала выращивают в аэрируемом реакторе, а затем переносят в меньший реактор со средой типа М-9, которая стимулирует образование шиконииа. Далее культуру переносят в третий емкостный реактор, в котором в течение 14 сут шиконин накапливается в клетках. О выходе продукта компания, производящая шиконин, не сообщала; согласно независимым оценкам, производительность установки составляет около 5 кг шиконина за один периодический процесс. Очевидно, трудозатраты, расходы на сооружение установки и приобретение дорогой среды должны окупаться высокой стоимостью продукта. Действительно, продажная цена шиконина в октябре 1983 г. составляла 4000 долларов за килограмм!
Заключение
В этой главе мы рассмотрели основы расчета и проектирования реакторов и основные принципы соответствующих технологий, которые находят применение в настоящее время и, возможно, будут использоваться в будущем для производства тех или иных продуктов с помощью микроорганизмов или клеток высших организмов. Мы попытались показать, как на основе данных о кинетике биологических процессов и параметров, характеризующих течения и перемешивание в реакторе, можно составить математическое описание процесса, пригодное для его расчета и оптимизации. Такой традиционный и успешно применявшийся в классической химической технологии подход к решению проблем технологии химических реакций уходит своими корнями в химическую и нефтеперерабатывающую промышленность. К сожалению, вследствие отсутствия достаточного количества данных о кинетике биологических превращений, применения сложных сред с неопределенным составом и непредсказуемыми эффектами, использования реакторов с нечетко определенными структурой течений и параметрами перемешивания, а также в силу того, что до сих пор не проводилось комплексных работ по поиску более систематических универсальных и надежных методов расчета биореакторов, разработанные с помощью описанной в этой главе систематической методологии режимы работы биореакторов и спецификации соответствующих проектов встречаются крайне редко.
Масштабирование биопроцессов чаще всего осуществляют в нескольких последовательных экспериментах с постепенным увеличением масштаба (что, естественно, приводит к удорожанию проектных работ), причем масштабы последовательных экспериментов гораздо меньше отличаются один от другого, чем в случае аппаратов и процессов химической технологии. При разработке биологического реактора периодического действия в настоящее время основная задача, скорее всего, будет заключаться в обеспечении необходимой скорости массопереноса, а не в расчете оптимального режима работы реактора на основе данных о кинетике процесса.
Опыт работы отраслей промышленности, в которых широко применяются методы химической технологии, показывает, что за счет оптимизации процессов можно добиться существенного снижения капитальных вложений и эксплуатационных расходов, уменьшения количества побочных продуктов и повышения выхода основного продукта. Кроме того, в нефтеперерабатывающей промышленности благодаря хорошо разработанной теории процессов и аппаратов масштаб процесса можно обычно увеличивать в 10 000 раз, что соответствует непосредственному переходу от лабораторной установки к крупномасштабному аппарату. Поскольку в ближайшем будущем откроется возможность получения многих новых продуктов с помощью новых организмов и новых процессов, мы вправе надеяться на развитие технологии биохимических процессов, что позволит обеспечить большую эффективность масштабирования, проектирования к эксплуатации биореакторов. Это в свою очередь будет способствовать повышению их надежности и ускорению экономически оправданного внедрения биопроцессов в промышленность.
Следующая глава будет посвящена знакомству с контрольно-измерительной аппаратурой для биореакторов. Отсутствие данных о явлениях переноса основных компонентов системы и химических процессах в реакторе ограничивают число методов контроля для установления оптимального режима работы реактора. Хотя в следующей главе основное внимание будет уделено контролю и регулированию процессов в емкостных реакторах, большая часть рассматриваемых контрольно-измерительных приборов может с тем же успехом применяться и для аппаратов с восходящим или нисходящим потоком. Закончив изучение контрольно-измерительной аппаратуры, мы перейдем к рассмотрению основных процессов разделения, позволяющих превратить выходящий из биореактора поток смеси веществ в достаточно чистый целевой продукт.
Вопросы
- Охарактеризуйте особенности идеального трубчатого реактора полного вытеснения (ТРПВ).
- Охарактеризуйте факторы определяющие время выравнивания концентраций в реакторах с перемешиванием.
- Опишите закономерности проектирования и проведения расчета биологических реакторов.
- Опишите кинетику процесса утилизации субстрата, образования продуктов метаболизма и биомассы в культурах клеток.
- Охарактеризуйте взаимосвязь между перемешиванием и биологическими превращениями.
- Дайте характеристику методам стерилизации при проектировании и расчете биологических реакторов.
- Охарактеризуйте методы периодической стерилизации при проектировании и расчете биологических реакторов.
- Охарактеризуйте методы непрерывной стерилизации при проектировании и расчете биологических реакторов.
- Дайте краткую характеристику иммобилизованным биокатализаторам.
10. Перечислите типы биокатализаторов на основе иммобилизованных клеток и их свойства.
11. Особенности реакторов периодического действия с добавлением субстрата.
Дата добавления: 2020-10-01; просмотров: 1100;











