СТАНДАРТНЫЕ МЕТОДЫ РАДИОНУКЛИДНОЙ ДИАГНОСТИКИ.
Занятие начинается с ознакомления с рутинными методами диагностики, представляющие скорее исторический интерес, но без них будет сложно разобраться в современных методах. Перед изучением данного материала следует напомнить, что постановка диагноза производится врачом-клиницистом на основании разнообразных методов исследований. Радионуклидная диагностика на основании полученных результатов исследований может выявлять сцинтиграфические признаки того или иного функционального поражения исследуемого органа, системы. (Это относится и к другим методам исследования).
Контактная бетта-фосфорная диагностика применяется для дифференциальной диагностики злокачественных и доброкачественных новообразований расположенных поверхностно на коже. Для проведения исследования необходим раствор 32Р, являющийся 100% бета-излучателем с длиной пробега в мягких тканях до 8 мм, который дается пациенту per os. Подсчет импульсов проводится на пораженном и здоровом участках кожи контактным способом при помощи обычного радиометра через 24, 48, 72 и 96 часов. В клетках злокачественной меланомы кожи минимальное накопление 32Р более 300% по сравнению со здоровым участком кожи, выведение препарата происходит медленно. Высокий процент накопления препарата в первые сутки и быстрое выведение являются признаками воспалительного процесса. Современным методом использования бета- излучений является использование позитронных эмиссионных томографов – ПЭТ, позволяющий не только получать числовую информацию, но и визуализировать пораженный участок, определять его положение, форму, размеры и т.д.
Исследование функции щитовидной железы при помощи дистанционной радиометрии проводится с применением раствора йодида натрия 131I, который дается пациенту строго натощак per os. Данный метод основан на тиреотропности йода. Радиометрия проводится с помощью импульсной счетной установки на расстоянии 30 см от пациента (см. рис. 1)
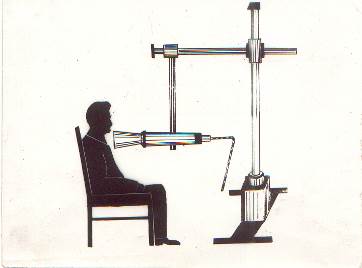
рис. 1
Результаты представлены на таблице.
| Пациенты | Метод исследования. | Время исследования | ||
| Через 2 часа | Через 4 часа | Через 24 часа | ||
| Здоровые | Сцинтилляционный дистанционный. | 10 – 20 % | 20 – 30 % | 30 – 50 % |
| Тиреотоксикоз | - - - # - - - | До 70% | До 83% | До 98% |
| Гипотиреоз | - - - # - - - | 0 – 4 % | 4 – 6 % | 1,2 – 6,8 % |
| Микседема | - - - # - - - | - | - | 1 – 4 % |
При проведении исследования, чтобы избежать ложных результатов, необходимо учитывать, что щитовидная железа накапливает и простой йод. Так при обработке кожи йодом, приеме с пищей продуктов содержащих йод (морская капуста) происходит так называемая «блокада» щитовидной железы. В таком случае исследование функции щитовидной железы необходимо отложить минимум на один месяц, при условиях, исключающих использование йодсодержащих веществ. Помимо этого, применение лекарственных препаратов, таких как бромсодержащих, антибиотиков, современных гипотензивных и др. зачастую приводит к медикаментозной блокаде щитовидной железы. Данный вид исследования противопоказан пациентам до 16 лет, беременным (беременность является противопоказанием для всех видов радионуклидных исследований), матерям в период лактации. Альтернативным методом является определение содержания гормонов щитовидной железы в плазме крови in vitro.
Сканирование щитовидной железы. Этот метод относится к статической форме регистрации распределения РФП. В настоящее время показанием для сканирования щитовидной железы является наличие пальпируемых образований в проекции щитовидной железы. Цель исследования – определение функционального состояния пораженного участка, что невозможно при других методах исследования (УЗИ). В качестве РФП используется Тс99m, который вводится внутривенно в процедурном кабинете. После экспозиции в течение 15 – 20 мин. производится сканирование. В заключении описывается положение щитовидной железы (в норме между перстневидным хрящом и вырезкой грудины), форма (состоит из двух долей и перешейка), контуры, размеры (площадь 25- 30 см2), интенсивность накопления и равномерность распределения РФП (в норме определяется равномерный переход цветовой гаммы от серого, кирпичного, светло- и темно-зеленого цвета на периферии до голубого, фиолетового, желтого, красного, малинового в центре, см. рис. № 2). При узловом зобе описывается его локализация, размеры, состояние функционирующей ткани. Возможны два варианта: интенсивное накопление в узле РФП - так называемый «горячий» очаг (см. рис. № 3), чаще являющийся сканографическим признаком токсической аденомы щитовидной железы, или отсутствие накопления – «холодный» очаг (см. рис. № 4), сканографический признак рака щитовидной железы.
 |  | ||
НОРМА ГОРЯЧИЙ ОЧАГ
рис. № 2 рис № 3
ХОЛОДНЫЙ ОЧАГ
 |
рис. № 4
Противопоказания к сканированию щитовидной железы те же, что и для определения функции щитовидной железы. В современных условиях проводится сцинтиграфия щитовидной железы при помощи гамма-камерной визуализации (как на обычных гамма-камерах, так и специально выпускаемых только для сцинтиграфии щитовидной железы). Это позволяет значительно ускорить процесс исследования и применять РФП 99mТс-пертехнетат, снижающий лучевую нагрузку на пациента и расширяющий показания к применению данного метода.
Радиоиммунологический анализ (РИА) – это метод «in vitro» диагностики, основанный на конкурентной реакции между меченым и немеченым антигеном за связь со специфической воспринимающей системой – антителом. Исследование проводится с сывороткой крови пациента, полученной при помощи венепункции иглой без применения шприца (для избежания гемолиза) в сухую центрифужную пробирку. Т.к. радиофармпрепарат не вводится в организм пациента, это исследование не связано с лучевой нагрузкой и не имеет противопоказаний. «In vitro» диагностика наиболее широко используется для определения гормонов щитовидной железы: трийодтиронина (Т3), тироксина (Т4), тиреотропного гормона гипофиза (ТТГ), для определения половых гормонов, как контроль за течением беременности, а также для определения кортизола, аденокортикотропного гормона и др.
Радиоренография. Гамма-камерная визуализация органов и систем: динамическая нефросцинтиграфия, динамическая гепатобиллисцинтиграфия, статическая сцинтиграфия печени, остеосцинтиграфия.
РРГ – радиоренография - динамический метод регистрации быстро текущих процессов, основанный на внутривенном введении РФП натрия о-йодгиппурат 131I непосредственно в диагностическом кабинете и начала записи данных с первой секунды после инъекции (для детей применяется метка 125I).
Показанием для проведения РРГ является изменения в анализе мочи, заболевания почек с целью определения их функционального состояния в динамике, гипертоническая болезнь и вегетососудистая дистония по гипертоническому типу (наличие ренальной гипертензии?), сахарный диабет.
Так как данный метод является функциональным, для избежания ложно отрицательных результатов, исследование не должно проводится натощак (в таких случаях необходимо, для стабилизации диуреза выпить до 300 гр. жидкости и выждать 20 мин.) и исключить стрессовые ситуации, дающие сосудистые реакции.
Исследования проводятся при помощи ренографа, датчики которого устанавливаются на область расположения почек. Результат выдается в виде ренографических кривых на дисплее (см. рис. № 5). Нормальная ренографическая кривая состоит из следующих сегментов: сосудистый – подъем кривой в течение 40 – 60 сек. после введения РФП, отображающий распределение препарата в сосудистом русле; секреторный - продолжающийся подъем кривой связанный с активной канальцевой секрецией, пик кривой обозначается - Т mах., у взрослых норма до 5 мин., у детей до 5 лет до 3 мин., до 10 лет до 4 мин., старше 10 лет норма как и у взрослых; экскреторный сегмент кривой начинается после достижения Тmax. и оценивается как - Т½.У взрослых норма до 10 мин., у детей до 5 лет до 6 мин., до 10 лет 8 мин. Показатель времени выведения – Т½ определяется в точке пересечения ниспадающей кривой с линией проведенной из середины высоты кривой параллельно оси абсцисс.
Патологические кривые:
- афункциональный тип кривой характеризуется наличием сосудистого сегмента и плавного снижения кривой.
- изостенурический тип кривой представлен сосудистым фрагментом, после которого, кривая идет параллельно оси абсцисс на протяжении всего исследования, т.е. в течение 20 мин. Наблюдается при хронической почечной недостаточности.
- обтурационный тип кривой состоит из сосудистого сегмента и секреторного, в течение 20 мин. наблюдения происходит накопление РФП без тенденции к выведению. Такой тип кривой наблюдается при мочекаменной болезни в случае закрытия просвета мочеточника камнем (блок почки), сдавления мочеточника опухолью, спайками и т.д.
- паренхиматозный тип кривой характеризуется снижением высоты кривой, по сравнению с нормальной, сглаженным Тmах, замедлением времени накопления (секреции) и выведения (экскреции) РФП и является, чаще всего, сцинтиграфическим признаком воспалительного поражения функционирующей ткани почек (при симметричном поражении – гломерулонефрита).
ГРАФИКИ КРИВЫХ
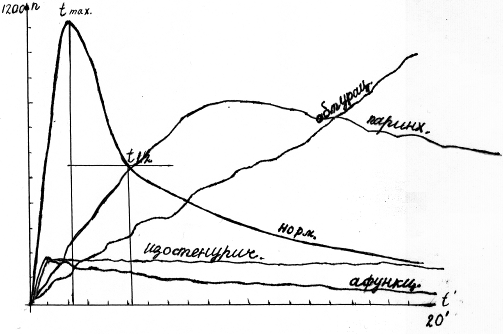 |
рис. № 5
Гамма-камерная визуализация органов и систем - современный метод радионуклидной диагностики. Этот метод позволяет одновременно визуализировать исследуемый орган, оценивать процессы накопления, распределения РФП в нем и, дополнительно, получать математическую информацию о состоянии функционирующей ткани, как при статических, так и динамических видах исследования. Гамма – камерная визуализация позволяет исследовать функциональные процессы, протекающие практически во всех органах и системах. Схема и возможности некоторых типов гамма-камер представлены на фотографиях.
ОДНОДЕТЕКТОРНАЯ ГАММА-КАМЕРА (см. рис. № 6)
 |
рис. № 6
ДВУХДЕТЕКТОРНАЯ ГАММА-КАМЕРА С ДВУМЯ ПРЯМОУГОЛЬНЫМИ ДЕТЕКТОРАМИ, УСТАНОВЛЕННЫМИ ПОД УГЛОМ В 900 (см. рис. № 7).
 |
рис. № 7
 |
ДВУХДЕТЕКТОРНАЯ ГАММА-КАМЕРА С ПРЯМОУГОЛЬНЫМИ ДЕТЕКТОРАМИ (см. рис. № 8).
рис. № 8
На примерах исследований, наиболее часто встречающихся в практике, ознакомимся с возможностями данного метода.
ДНС – динамическая нефросцинтиграфия. Показаниями к исследованию функционального состояния мочевыделительной системы данным методом являются заболевания почек и мочевыводящих путей особенно сопровождающиеся структурными изменениями, всевозможными дистопиями. Помимо регистрации временных и количественных показателей фармакокинетики РФП, определяется локализация патологического процесса, где конкретно происходит задержка препарата. РФП – пентатех + 99mТс вводится внутривенно после установки детектора на область исследования. Регистрация данных начинается одновременно с окончанием введения препарата и проводится каждые 20 сек. в течение 20 мин. исследования в виде сцинтиграмм, на которых поэтапно изображено поступление препарата в сердце, крупные сосуды, сосуды почек и его выведение (см. рис. № 9).
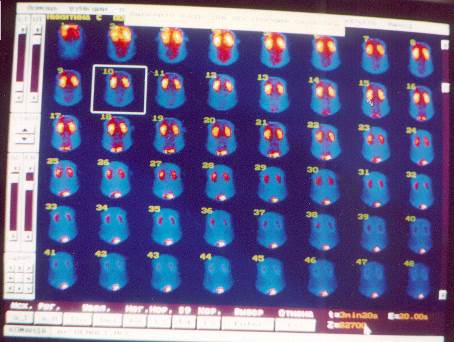
рис. № 9
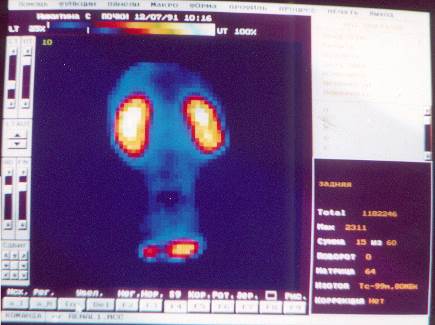 |
На полученных сцинтиграммах дается визуальная оценка накопления и выведения препарата, формы, размеров функционирующей ткани, учитывается и интенсивность накопления, распределения РФП, указывается локализация задержки, выбирается кадр для последующей математической обработки данных исследования (см. рис. № 10).
рис. № 10
Изображение на этом кадре является суммарным, служит для построения зон интереса, на основании которых будут построены кривые, математически определяющие временные показатели функции почек. При ДНС зонами интереса являются: сердце – кривая клиренса, правая и левая почки. На фотографии с дисплея компьютера изображено в правом верхнем углу построенные зоны интереса и в центре – полученные кривые (см. рис. № 11).
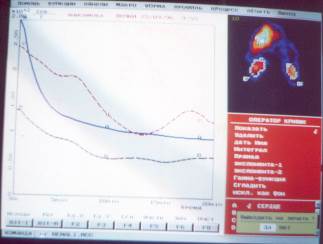 |
рис. № 11
Пример заключения нормально функционирующих почек:
СЦИНТИПРО 2.3
ИМЯ ПАЦИЕНТА --------------------------------------------
ИСТОРИЯ БОЛЕЗНИ ---------------------------------------------
ЛЕЧ. УЧРЕЖДЕНИЕ ----------------------------------------------
ДИАГНОЗ ------------------------------------------------------------
ИССЛЕДУЕМЫЙ ОРГАН ПОЧКИ
РФП, ВВОДИМАЯ АКТИВНОСТЬ пентатех+99mТс, 80 МБк
ЛУЧЕВАЯ НАГРУЗКА почки 2мЗв, моч. пузырь 8,9мЗв, тело 0,2мЗв
ЗАКЛЮЧЕНИЕ. На сцинтиграммах в положении сидя проекционное изображение функционирующей ткани почек расположено обычно, контуры ровные, размеры не увеличены, накопление препарата интенсивное, распределение равномерное, задержка РФП не визуализируется. Поступление препарата в мочевой пузырь выражено интенсивно.
Показатели фармакокинетики РФП в пределах нормы.
подпись:
МЕТОДИКА renal
ДИНАМИЧЕСКАЯ СЦИНТИГРАФИЯ норма:
Т 1/2 клиренса, мин. 2,3 до 4
ЛЕВАЯ ПОЧКА ПРАВАЯ ПОЧКА
Время максимума, мин. 3,2 2,7 5-7
Время полувыведения 14,3 12,5 до 18
Время 2/3 макс., мин. 6,4 5,9 до 9
Реноиндекс, % 51,3 49,7
Отношение максимумов 1,2 0,8
Нередко, особенно у детей, встречается врожденная дистопия почек (см. № 12).
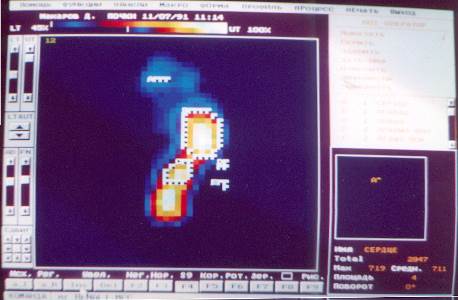 |
рис. № 12
ЗАКЛЮЧЕНИЕ. На сцинтиграммах в положении сидя проекционное изображение функционирующей ткани левой почки низко расположено в правой половине брюшной полости под изображением правой почки и над изображением мочевого пузыря. Контуры неровные, проекционные размеры уменьшены, накопление препарата снижено, задержка РФП визуализируется преимущественно в области проекции изображения лоханки. Изображение правой почки расположено обычно, форма сохранена, накопление препарата интенсивное, распределение равномерное, задержка РФП не визуализируется. Поступление препарата в мочевой пузырь выражено
интенсивно.
Показатели фармакокинетики РФП определяют выраженное замедление времени накопления и выведения препарата левой почкой, снижение ее реноиндекса.
подпись:
МЕТОДИКА renall норма
ДИНАМИЧЕСКАЯ СЦИНТИГРАФИЯ
Т 1/2 клиренса, мин 2.9 до 3
ЛЕВАЯ ПОЧКА ПРАВАЯ ПОЧКА
Время максимума, мин 13.7 4.7 до 5
Время полувыведения 32. 6 14.8 до 15
Время 2/3 максимума ----- 7.3 до 8
Реноиндекс , % 24.6 75.4
Отношение максимумов 0.6 1.8
Кроме ДНС для исследования функционального состояния почечной ткани применяется СНС - статическая нефросцинтиграфия. Показанием для проведения СНС является наличие структурных изменений в почках, например, таких, как кисты, опухоли. На планарных гамма-камерах исследование проводится в двух проекциях – прямой и косой, что не требуется при проведении данного исследования на томографической гамма-камере с двумя детекторами.
ДГБС – динамическая гепатобиллисцинтиграфия. Показанием к применению являются заболевания печени, желчного пузыря, желчевыводящих путей, желтухи различной этиологии и другие поражения панкреатодуоденальной зоны. Бромезида+99Тс может быть использована при уровне билирубина в крови выше 150 мкмоль/л.
Исследование проводится строго натощак в положении лежа. Воспринимающий детектор устанавливается с таким учетом, чтобы в поле зрения оказалось изображение сердца, печени, желчного пузыря и кишечника – зон интереса, с которых будут получены основные параметры функционального состояния печени, желчных протоков желчного пузыря, т.е. определены признаки внутри- или внепеченочного холестаза, в виде графиков кривых активность-время. Регистрация протекающих процессов продолжается в течение 100 мин с получением сцинтиграмм каждую минуту. На пике накопления РФП в желчном пузыре (»на 40 мин) пациенту дают пробный завтрак – два сырых куриных желтка. На представленных сцинтиграммах визуализируется поступление РФП по системе: кровь, сердце, печень, желчные протоки, желчный пузырь, кишечник (см. рис. №№ 13 – 15).
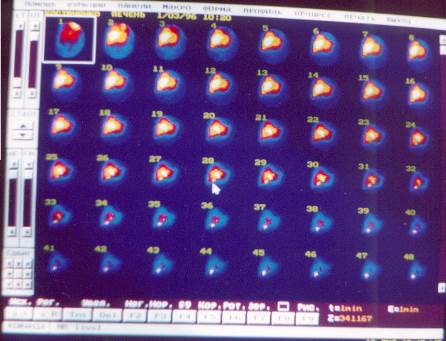 |
Рис. № 13
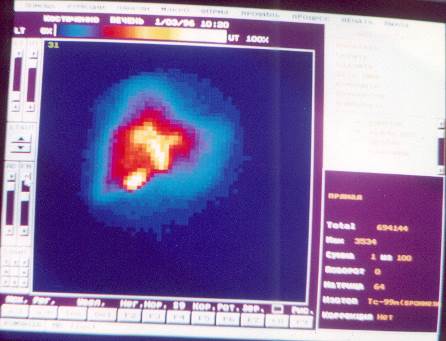 |
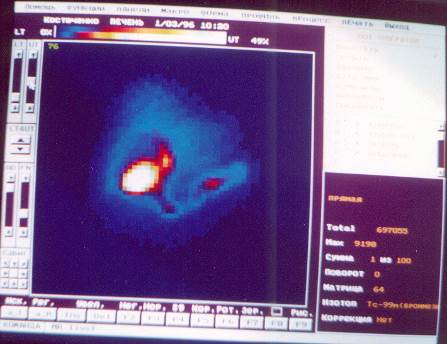 |
рис. № 14
рис. № 15
ЗАКЛЮЧЕНИЕ. На сцитиграммах в передней проекции изображение печени неправильной треугольной формы с преобладанием высоты. Естественные вырезки сглажены. Накопление препарата средней интенсивности, распределение – диффузно-неравномерное. Проекционные размеры функционирующей ткани печени увеличены за счет правой доли(19х6х17 по Курлову). Показатели фармакокинетики РФП отражают снижение накопительной функции гепатоцитов, замедление времени выведения препарата паренхимой печени. Желчные протоки расширены. Поздняя визуализации желчного пузыря является сцинтиграфическим признаком хронического холецистита. Желчный пузырь грушевидной формы, деформирован в области проекции изображения шейки. Снижение двигательной функции желчного пузыря при нормальном коэф. накопления, является сцинтиграфическим признаком гипомоторной дискинезии. Замедление времени латентного периода (времени от дачи пробного завтрака до появления РФП в 12типерстной кишке) является косвенным сцинтиграфическим признаком патологии гастродуоденальной зоны.
Динамическая сцинтиграфия печени с бромезида. Норма:
Время дачи завтрака 40 мин
Появление РФП в желчном пузыре 23 мин до 20 мин
Время достижения максимума в печени 15 мин 7- 13 мин
Время полувыведения печени 36 мин 19-30 мин
Показатель двигательной функции ж.п. % 32 % 35-55 %
Коэф. накопления желчного пузыря ( на 40 мин) 11.46 6- 15
Время латентного периода 13 мин 1-9 мин
ССП – статическая сцинтиграфия печени. Показанием к этому виду исследования являются диффузные (гепатиты, циррозы) и очаговые (кисты, метастазы) поражения печени.
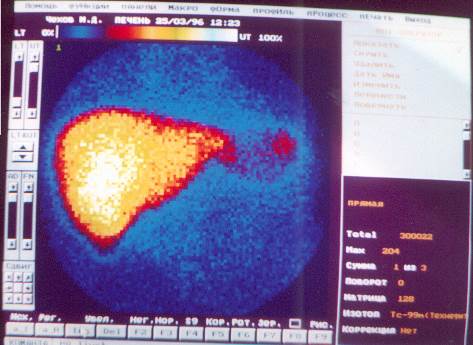 |
РФП технефит+99mТС вводится внутривенно в процедурном кабинете, после введения пациент находится в комнате ожидания исследования 30 мин. Сцинтиграммы производятся в трех проекциях: передней, задней и боковой (см. рис. №№ 16 – 17).
рис. № 16
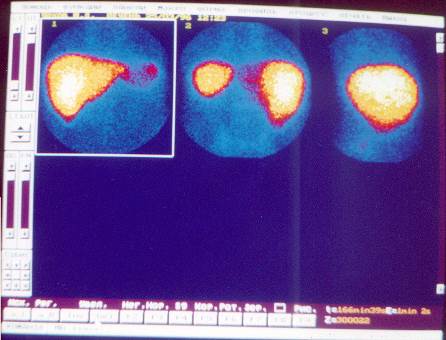 |
рис. № 17
ЗАКЛЮЧЕНИЕ. На сцинтиграмме в передней проекции изображение печени расположено обычно, неправильной треугольной формы с преобладанием длины. Естественные вырезки сглажены, проекционные размеры функционирующей ткани увеличены преимущественно за счет левой доли. Накопление препарата интенсивное, распределение – диффузно-неравномерное. Изображение селезенки визуализируется слабо, в размерах не увеличено, накопление препарата в пределах нормы.
В задней проекции изображение селезенки визуализируется отчетливо, увеличено в размерах, процент накопления препарата повышен. Включение РФП в позвоночник не визуализируется.
В боковой проекции распределение РФП диффузно-неравномерное, передне-задний размер печени до 18 см (в норме до14см).
Сцинтиграфические признаки хронического персистирующего гепатита.
подпись:
СЦИНТИГРАФИЯ ПЕЧЕНИ.
| Спереди | Сзади | Суммарная | |
| Печень Селезенка | 96 % 4 % | 81 % 19 % | 88.5% 11.5% |
Размеры печени: 17х9х20 см норма: 14,6 ± 1см, 6,7±1см, 17,1±0,6 см.
Размеры селезенки: 10х8 см норма 9 х 6 см
#
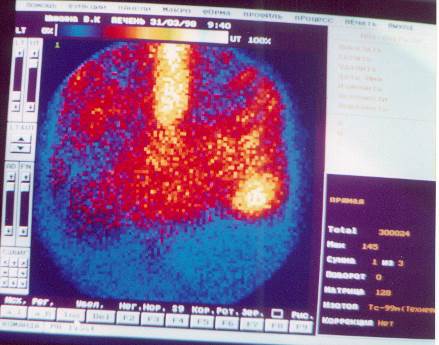 |
рис. № 18
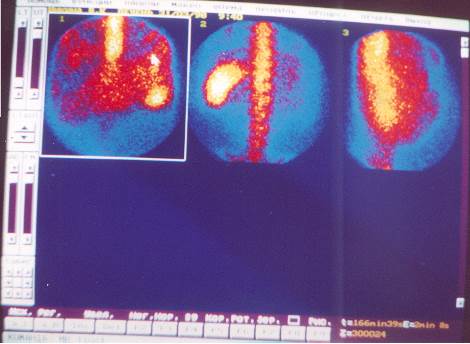 |
рис. № 19
ЗАКЛЮЧЕНИЕ. На сцинтиграмме в передней проекции изображение печени неправильной треугольной формы, края деформированы, накопление препарата низкое, распределение очагово-неравномерное, проекционные размеры резко увеличены. Изображение селезенки визуализируется отчетливо, увеличено в размерах, накопление препарата повышено. Определяется включение РФП в грудину и ребра.
В задней проекции изображение функционирующей ткани печени практически не визуализируется, селезенка увеличена в размерах, процент включения препарата значительно повышен. Визуализируется включение РФП в позвоночник и кости таза.
В боковой проекции визуализируется включение РФП в позвоночник, изображение печени не визуализируется.
Сцинтиграфические признаки резко выраженного цирроза печени (см. рис. №№ 18 – 19).
подпись:
СЦИНТИГРАФИЯ ПЕЧЕНИ
| Спереди | Сзади | Суммарная | |
| Печень Селезенка | 44% 56% | 16 % 84 % | 30 % 70% |
Размеры печени: 19х11х22 см
Размеры селезенки: 18х 11 см
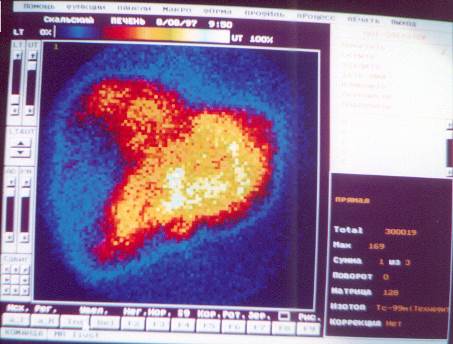 |
рис. № 20
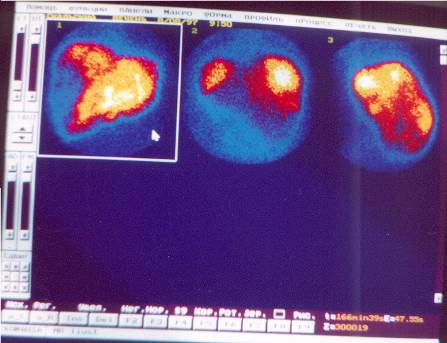 |
рис. № 21
ЗАКЛЮЧЕНИЕ. На сцинтиграмме в передней проекции изображение печени деформировано. Проекционные размеры функционирующей ткани увеличены, изображение печени наслаивается на изображение селезенки. По наружному краю визуализируется дефект накопления РФП овальной формы 11х5 см. Накопление препарата снижено в левой доле, распределение – диффузно-неравномерное.
В задней проекции изображение печени деформировано в области проекции изображения нижнего края правой доли. Изображение селезенки визуализируется отчетливо, увеличено в размерах, накопление препарата повышено. Включение РФП в позвоночник не визуализируется.
В боковой проекции передне-задний размер печени до 22 см, определяется дефект накопления РФП в нижнем сегменте правой доли.
Сцинтиграфические признаки крупноочагового поражения печени (см. рис. №№ 20 – 21).
подпись:
СЦИНТИГРАФИЯ ПЕЧЕНИ
| Спереди | Сзади | Суммарно | |
| Печень Селезенка | 100 % 0 % | 84 % 16 % | 92 % 8 % |
Размеры печени: 21х14х23 см
Размеры селезенки: 10х7 см
Остеосцинтиграфия, представляет еще один статический метод исследования в радионуклидной диагностике, который основан на способности РФП технефор +99mТс накапливаться в костной ткани. В норме накопление радиофармпрепарата в различных участках костей скелета связано с состоянием кровоснабжения. Относительное его повышение визуализируется в области суставов, метафизах длинных трубчатых костей, в области лицевого черепа, глотки, хрящах гортани, рукоятке и теле грудины, крестцово-подвздошном сочленениях, в зонах роста у молодых людей, старых переломах. На этой способности и основана диагностика патологических поражений костной системы.
Данный метод исследования показан при первичных и вторичных (метастатических) злокачественных опухолях, остеомиелитах, туберкулезном поражении костей и суставов. При этом сцинтиграфическая картина всех выше перечисленных заболеваний будет схожа, т.к. накопление препарата всегда будет высоким в участках с повышенным кровоснабжением и низким при дегенеративно-деструктивных процессах. Основание для дифференциальной диагностики дает клиническая картина заболевания. Преимуществом данного метода диагностики является более раннее выявление метастатического поражения костей, на 6 - 8 месяцев раньше, чем проявляется рентгенологические признаки деструкции, т.к. попавшая в кость метастатическая клетка до разрушения костных балок нуждается в высоком кровообращении, и этот процесс фиксируется на сцинтиграммах. Наиболее часто метастазы в кости встречаются при раке молочной железы, предстательной железы и раке легкого. Введение РФП проводится в процедурном кабинете, после введения пациент находится в комнате ожидания исследования 3 часа. Обязательным условием для получения сцинтиграмм является полное опорожнение мочевого пузыря.
При исследовании на планарных гамма-камерах сцинтиграммы получают в передней и задней проекциях. В случае визуального выявления участка с повышенным накоплением он обозначается как зона интереса и сравнивается с симметричным непораженным участком или выше лежащим (например, позвонком). Разница 10% не учитывается, от 10 до 30% - называется участком повышенного накопления препарата, 30% и более – очагом гиперфиксации и, при наличии клинических данных, является сцинтиграфическим признаком метастаза (см. рис. №№ 22 -23).
 |
рис. № 22
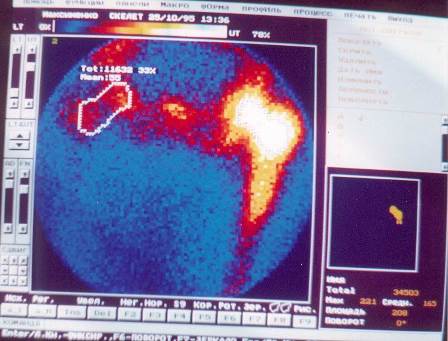 |
рис. № 23
МЕТОД остеосцинтиграфия
ЗАКЛЮЧЕНИЕ. На сцинтиграммах костей скелета выявлены очаги гиперфиксации РФП в области проекции изображений:- крыла левой подвздошной кости до 36%; крыла правой подвздошной кости до 32%; левого тазобедренного сустава с переходом на верхнюю треть бедра до 67%; 4, 6-7 ребер слева по передне-подмышечной линии до 41%;теменной и височной кости до 43%; левой лопаточной кости до 33%; 7 грудного позвонка и всего 7 ребра слева до 37%; 1-3 поясничных позвонков до 44%; тела левой подвздошной кости до 53%.
подпись:
Виды ионизирующего излучения, применяемые с лечебной целью Радиобиологические основы лучевой терапии. Планирование лучевого лечения злокачественных заболеваний.
Излучение, приводящее при взаимодействии с веществом к появлению электрических зарядов разных знаков (ионов, называется ионизирующим). В процессе ионизации происходит отрыв одного или нескольких электронов от атома.
По физическим свойствам ионизирующие излучения разделяют на два вида: квантовое и корпускулярное. К квантовому излучению относятся рентгеновское и гамма-излучения, представляющие собой электромагнитные колебания и характеризующиеся определенной длиной волны.
Рентгеновское излучение возникает при столкновении быстрых электронов с атомами вещества анода в рентгеновской трубке, при этом энергия его фотонов составляет 0,05-400 кэв, максимум поглощенной дозы находится практически на облучаемой поверхности, а слой половинного ослабления на расстоянии 6 см. При торможении электронов с атомами мишени в ускорителях (линейные ускорители, циклические: циклотроны, беттатроны образуется рентгеновское тормозное излучение, обладающее энергией от 4 до 45 МэВ и может использоваться для лечения глубоко расположенных опухолей. Преимущества ускорителей заключаются в следующем: существует возможность выбора вида излучения (квантовое или электронное) и регулирования энергии излучения, небольшие размеры сечения пучка электронов на мишени (0,5-3 мм), небольшой вклад рассеянного излучения и, следовательно, меньшая интегральная доза вне полезного пучка, высокая мощность дозы в рабочем пучке излучения.
Гамма-излучение отличается от рентгеновского только механизмом происхождения. Гамма-кванты испускаются самопроизвольно и непрерывно естественными радиоактивными веществами. Наиболее часто в клинической практике применяют радиоактивный кобальт-60 с энергией квантов 1, 25 МэВ и цезий-137 с энергией квантов 0,66 МэВ. При гамма-терапии кобальтом-60 максимальная доза находится на глубине 5-6 мм, а слой половинного ослабления равен 12 см.
Корпускулярные излучения:
Бета-излучение представляет собой поток отрицательно и положительно заряженных частиц, обладающих ничтожной массой 1/1840 массы атома водорода и большой скоростью 87-298 тыс. км/сек.
Проникающая способность в мягких тканях составляет 1 см. Источниками бета-излучения являются йод-131, фосфор-32, иттрий-90, золото-198, которые вводят в виде коллоидных растворов или рассасывающихся материалов при контактной терапии.
Излучение высоких энергий получают в специальных ускорителях.
К ним относятся:
а) нейтронное излучение-поток нейтронов, элементарных частиц, не имеющих заряда, с массой 1, 00897 атомной единицы массы. Источниками нейтронов являются ускорители и ядерные реакторы (для дистанционного облучения), а также калифорний-252, который успешно применяется при внутритканевой, внутриполостной и аппликационной терапии в лечении опухолей головы и шеи.
Основным преимуществом использования нейтронного облучения является:
- отсутствие зависимости повреждения:
а) от фазы клеточного цикла
б) от степени насыщения клеток кислородом;
2. Низкая вероятность репарации сублетальных повреждений
3. Слабая разница в радиочувствительности клеток различных опухолей.
б) протонное излучение-поток положительно заряженных частиц с массой, равной 1,00758 атомной единицы массы, образующиеся при ионизации атомов водорода. Протонное излучение успешно используется при лечении опухолей головного мозга. Преимуществом протонов перед перечисленными выше видами ионизирующих излучений является способность образовывать в конце своего пробега в тканях максимум ионизации (пик Брэгга-Грея), что позволяет более эффективно воздействовать на опухолевые клетки при щажении здоровых тканей, так как доза в пике превосходит таковую в окружающих тканях в 2,5-3,5 раза;
в) пи-мезонное излучение-поток положительных, отрицательных и нейтральных частиц, имеющих промежуточную массу электрона и протона. Плотность ионизации у пи-мезонов увеличивается к концу пробега.
Радиобиологические основы лучевой терапии злокачественных опухолей.
В основе лучевой терапии злокачественных опухолей лежит способность ионизирующего излучения подавлять функцию размножения и роста, а при более интенсивном воздействии вызывать гибель опухолевых клеток. Проведение опухолевой терапии возможно благодаря существованию радиотерапевтического интервала. Радиотерапевтический интервал-это различие в радиочувствительности и радиопоражаемости здоровых и опухолевых тканей, что реализуется в более быстром восстановлении здоровых клеток по сравнению с опухолевыми после сублетального лучевого повреждения.
Различное действие ионизирующего излучения на опухолевые и здоровые клетки объясняет закон Трибондо-Бергонье (1906 г.), который гласит, что радиочувствительность тканей прямо пропорциональна их митотической активности и уровню тканевого обмена и обратно пропорциональна степени дифференциации клеток.
Ионизирующее излучение вызывает гибель клетки двумя путями. По современным представлениям клетка гибнет в результате поражения ядерных структур-ДНК, дезоксирибонуклеопротеидов. Облучение приводит к разрыву ДНК. Это так называемый механизм прямого воздействия на клетку. Вторым механизмом в лучевом повреждении клеток является непрямое воздействие, при котором происходит радиолиз воды. В результате образуются перекисные соединения, обладающие высокой окислительной активностью. Вступая во взаимодействие с глюконуклеолипопротеидами клетки, они изменяют ее жизнедеятельность.
Биологический эффект ионизирующего излучения зависит от следующих факторов:
- вида излучения. Эффективность биологического действия различных видов излучения неодинакова. Это значит, что равные по физическому значению дозы оказывают разное действие на организм. Различное действие на организм обусловлено неодинаковой проникающей способностью разных видов излучения и плотностью ионизации. Для характеристики этих различий введено понятие относительной биологической эффективности (ОБЭ), отражающее разницу в биологическом действии сравниваемых видов излучения.
ОБЭ - отношение поглощенной дозы (До) образцового излучения (рентгеновское излучение при 200 кВ), вызывающего определенный биологический эффект, к поглощенной дозе (Д) рассматриваемого излучения, вызывающей тот же эффект.
Одним из важнейших параметров при определении ОБЭ является линейная плотность ионизации. Способность заряженных частиц вызывать ионизацию пропорциональна квадрату заряда и обратно пропорциональна скорости движения частиц. Таким образом, чем больше заряд и меньше скорость, тем больше актов ионизации вызовет частица на своем пути, тем выше ее биологическая эффективность. Быстрые электроны относятся к редкоионизирующим излучениям; протоны, нейтроны и другие тяжелые частицы наоборот являются плотноионизирующими. Относительная биологическая эффективность более выражена при воздействии плотноионизирующего излучения (ОБЭ: рентгеновского излучения=1; гамма излучения Со 60=0,85-0,9; быстрых электронов (бетатрон 23 МЭВ)=1,59; быстрых нейтронов=10; альфа-излучения=15-20)
- величины поглощенной дозы. С повышением дозы излучения увеличивается число образованных в тканях ионов и соответственно увеличивается степень биологического эффекта;
- объема облучаемых тканей. Чем больше объем облученных тканей тем более выражена ответная биологическая реакция;
- распространения дозы во времени. Ответная биологическая реакция будет тем больше, чем короче срок подведения дозы.
Эффективность лучевой терапии зависит от радиочувствительности клеток. Установлено, что после облучения вымирание «рода» облученной клетки происходит не сразу, а на уровне нескольких поколений. В одном случае может погибнуть сама облученная клетка, в другом - дочерние клетки. Это объясняет тот факт, что регрессия опухоли наступает не сразу, а спустя 2-3 недели после облучения.
В связи с этим способность облученной клетки к репарации и время наступления регрессии опухоли является характеристикой клеточной пролиферации, а не радиочувствительности опухолевых клеток.
Радиочувствительность определяют по степени снижения эффективности колониеобразования после облучения. Образование клеткой видимой глазу колонии, т.е. имеющей диаметр в сотни микрон, означает, что клетка совершила не менее 6 делений и сохранила после облучения способность к неограниченной пролиферации. Оценивая радиочувствительность по данной методике, злокачественные опухоли разделили на:
- Радиочувствительные (лимфосаркома, лимфогранулематоз, опухоль Вильмса, семинома, опухоль Юинга, базальноклеточный рак).
- Умеренно радиочувствительные (плоскоклеточный рак).
- Умеренно радиорезистентные (аденокарцинома).
- Радиорезистентные (остео-, -хондро-, миксо-, нейро-, липо-, миосаркомы, меланомы).
Кроме того на чувствительность опухолей влияет ряд клинических факторов:
1. Размеры опухоли. Опухоли небольших размеров более чувствительны.
2. Ги
Дата добавления: 2016-07-18; просмотров: 3456;











