Теория фазовых переходов и критические явления применительно к нефтегазовым пластовым системам.
На предыдущей лекции мы пришли к выводу, что разрабатываемую залежь следует рассматривать как единую пластовую фильтрационную систему (ПФС), включающую в себя: флюидальную (пластовые флюиды) и коллекторную компоненты (пористая среда). Эффективная разработка залежей ТРИЗ возможна только при условии того или иного способа воздействия на эту залежь.
Мы говорили о том, что на процессы разработки нефтяных, нефтегазовых и газоконденсатных месторождений большое влияние оказывают фазовые превращения пластовой смеси.
Моделирование фазовых превращений в значительной степени осложнено наличием пористой среды, которую насыщает пластовая смесь.
Мы познакомились с тем, как строятся фазовые диаграммы при помощи адиабатического калориметра.
2. Свойства идеальных и реальных газов. Фазовые диаграммы. (ПЗ – 6 ч., СР – 4 ч.).
Законы термодинамики. Термодинамическая система. Параметры состояния. Уравнение состояния идеального газа. Свойства идеального газа. Теплоемкость, энтальпия, энтропия. Реальный газ. Фактор сжимаемости природных газов. Вириальное уравнение состояния, уравнение Майера - Боголюбова. Уравнение Ван – дер - Ваальса. Пограничные кривые, критические параметры. Метастабильные и лабильные состояния. Фазовая диаграмма давление – температура чистых веществ, фазовые диаграммы плотность- температура, давление - удельный объем чистых жидкостей. Соответственные состояния, критический коэффициент сжимаемости.
Законы термодинамики.
А сейчас обсудим основные проблемы равновесной термодинамики.
Термодинамика представляет собой классический пример аксиоматически построенной науки. В основе её лежат несколько фундаментальных законов, которые являются обобщением нашего опыта и рассматриваются как аксиомы. В этом смысле термодинамика аналогична евклидовой геометрии.
Чтобы подчеркнуть аксиоматический характер основных законов термодинамики и их общность, о них говорят как о началах термодинамики. Обычно выделяют четыре начала термодинамики.
Четыре начала термодинамики в формулировке известного немецкого физика А.Зоммерфельда.
Нулевое начало (температура как функция состояния).
Существует функция состояния – температура. Равенство температур во всех точках есть условие равновесия двух систем или дух частей одной и той же системы.
Термодинамика занимается изучением свойств физических систем в состоянии равновесия. Любой вывод, приводящий к введению температуры, относится к термодинамическому равновесию. Поэтому температура определена только для состояний равновесия.
Температура выступает как мера средней энергии теплового движения молекул. Она связана со средней кинетической энергией частиц системы следующим выражением:
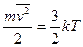 (1)
(1)
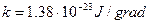 - постоянная Больцмана.
- постоянная Больцмана.
Из этого соотношения следует, что температура является функцией мгновенного распределения скоростей молекул, то есть функцией состояния системы. Она не зависит от предыстории системы и полностью определяется состоянием системы в данный момент времени.
Температура не единственная функция состояния. Любая физическая величина, имеющая определённое значение для каждого равновесного состояния системы, является функцией состояния и называется термодинамической величиной. К ним относятся, например, температура давление, внутренняя энергия и т.д.
Термодинамические величины или функции состояния – это тот язык, на котором разговаривает термодинамика.
Напомню, что основными понятиями классической механики являются координаты и импульсы составляющих её частиц.
Квантовая механика описывает процессы на языке волновых функций.
Работа и теплота в термодинамике не являются функциями состояния, а 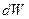 и
и 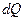 не есть полный дифференциал какой-либо функции состояния.
не есть полный дифференциал какой-либо функции состояния.
Первое начало термодинамики (закон сохранения энергии).
Каждая термодинамическая система обладает характеристической функцией состояния – энергией. Эта функция состояния возрастает на величину сообщённого системе тепла 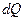 и уменьшается на величину совершённой системой внешней работы. Для изолированных систем справедлив закон сохранения энергии (справедлив независимо от того, находится ли система в равновесии или нет).
и уменьшается на величину совершённой системой внешней работы. Для изолированных систем справедлив закон сохранения энергии (справедлив независимо от того, находится ли система в равновесии или нет).
Первое начало термодинамики:
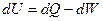
определяет новую функцию состояния – внутреннюю энергию U («эн» – ёмкость, «эрг» - «работа»). Под внутренней энергией подразумевается энергия системы, зависящая от её внутреннего состояния (энергия теплового движения всех микрочастиц системы и энергия их взаимодействия).
Кинетическая энергия движения системы как целого и её потенциальная энергия во внешних силовых полях во внутреннюю энергию не входят.
Тепло, полученное системой, идёт на приращение её внутренней энергии и на производство внешней работы.
Дата добавления: 2016-07-18; просмотров: 1528;











