Термодинамические потенциалы и характеристические функции.
Фундаментальное уравнение термодинамики для закрытых систем, в которых не идут химические реакции
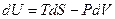
В это уравнение входят пять переменных 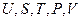 . Три величины
. Три величины 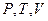 можно измерить. Изменение внутренней энергии
можно измерить. Изменение внутренней энергии 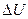 можно измерить при условии постоянства объёма. Энтропия
можно измерить при условии постоянства объёма. Энтропия 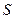 не может быть непосредственно измерена, но может быть рассчитана, если известны остальные величины. Параметры
не может быть непосредственно измерена, но может быть рассчитана, если известны остальные величины. Параметры 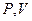 и
и 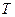 связаны между собой термическим уравнением состояниявида
связаны между собой термическим уравнением состояниявида
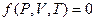 .
.
поэтому можно выбрать только два независимых параметра.
Внутренняя энергия может быть выражена через термические параметры с помощью калорического уравнения состояниявида
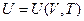 .
.
Оба уравнения состояния системы выбираются на основании экспериментальных данных или теоретических представлений.
Построениекалорического уравнения состояния на основе измерения теплоёмкости.
Теплоёмкость.
Теплоёмкость тела С называется отношение бесконечно малого количества тепла 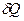 , полученного телом, к соответствующему приращению
, полученного телом, к соответствующему приращению 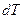 его температуры:
его температуры:
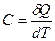 .
.
Когда масса тела равна единице, теплоёмкость называется удельной. Более удобна молярная теплоёмкость – теплоёмкость одного моля вещества.
Приращение температуры 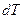 не определяет ещё полностью того бесконечно близкого состояния, в которое переходит система из заданного состояния.
не определяет ещё полностью того бесконечно близкого состояния, в которое переходит система из заданного состояния.
Рассмотрим, например, физически однородное тело, состояние которого полностью определяется двумя параметрами, в качестве которых можно взять объём и температуру.
Пусть исходное состояние изображается точкой 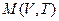 (см. рис.). Проведём прямую
(см. рис.). Проведём прямую 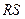 , параллельную оси объёмов и отстоящую от точки
, параллельную оси объёмов и отстоящую от точки 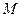 на величину
на величину 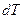 . Все точки этой прямой изображают состояния с одной и той же температурой
. Все точки этой прямой изображают состояния с одной и той же температурой 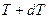 , но с различными объёмами. Система из состояния
, но с различными объёмами. Система из состояния  может перейти в различные близкие состояния
может перейти в различные близкие состояния  , лежащие на этой прямой. Всем этим переходам соответствует одно и то же повышение температуры, но, вообще говоря, различные количества тепла
, лежащие на этой прямой. Всем этим переходам соответствует одно и то же повышение температуры, но, вообще говоря, различные количества тепла 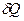 . Будут разными и теплоёмкости системы при таких переходах.
. Будут разными и теплоёмкости системы при таких переходах.
Поэтому теплоёмкость есть характеристика не одного какого-либо состояния системы, а двух бесконечно близких состояний её, из которых одно является начальным, а другое конечным.
Вместо двух бесконечно близких состояний можно задать одно из них и направление пути перехода системы в бесконечно близкое состояние.
Таким образом, теплоёмкость не есть функция состояния тела, а является характеристикой бесконечно малого процесса, совершаемого телом.
Придадим этим рассуждениям количественную форму.
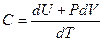
Так как
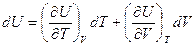
то
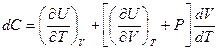
Объём 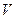 зависит не только от температуры
зависит не только от температуры 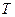 , но и от даления
, но и от даления 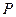 . В зависимости от того как меняется давление, отношение
. В зависимости от того как меняется давление, отношение 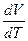 может принять любое значение. Чтобы придать этому выражению однозначный смысл, надо фиксировать значение этого отношения. Иными словами, надо указать в плоскости
может принять любое значение. Чтобы придать этому выражению однозначный смысл, надо фиксировать значение этого отношения. Иными словами, надо указать в плоскости 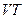 направление пути, по которому система переходит в бесконечно близкое состояние.
направление пути, по которому система переходит в бесконечно близкое состояние.
Так как это направление может быть любым, то теплоёмкость 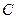 , вообще говоря, может принимать любые значения от
, вообще говоря, может принимать любые значения от 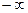 до
до 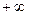 . В частности:
. В частности:
для изотермического процесса 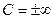 , так как в этом случае
, так как в этом случае 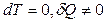 .
.
для адиабатического процесса 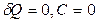 .
.
Особое значение имеют теплоёмкости при постоянном объёме (изохорная теплоёмкость 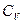 ) и постоянном давлении (изобарная теплоёмкость
) и постоянном давлении (изобарная теплоёмкость 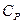 ).
).
Если объём остаётся постоянным, то 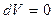 , и следовательно,
, и следовательно,
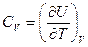 .
.
Если процесс протекает при постоянном давлении, то на основании определения энтальпии 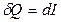 . Поэтому
. Поэтому
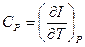
В фундаментальное уравнение термодинамики для закрытых систем 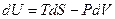 входят пять переменных
входят пять переменных 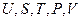 . Три величины
. Три величины 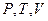 можно измерить. Независимыми параметрами могут быть любые два из перечисленных пяти переменных, поэтому возможно записать целый ряд термодинамических функций состояния двух независимых переменных:
можно измерить. Независимыми параметрами могут быть любые два из перечисленных пяти переменных, поэтому возможно записать целый ряд термодинамических функций состояния двух независимых переменных: 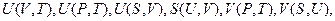 и т.д.
и т.д.
В термодинамике чаще применяют для описания системы характеристическиефункции.
Функция состояния системы двух независимых параметров называется характеристической, если посредством этой функции и её производных по этим параметрам могут быть выражены все термодинамические свойства системы.
Например, функция 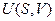 – характеристическая.
– характеристическая. 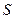 и
и 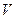 являются независимыми параметрами, а
являются независимыми параметрами, а 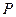 и
и 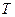 определятся на основе уравнения
определятся на основе уравнения 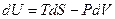 (*).
(*).
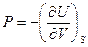 ,
, 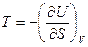
А величина энтальпии определится из соотношения
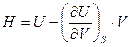
Можно легко убедиться, что такие функции, как 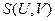 и
и 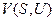 также являются характеристическими. Можно записать ещё целый ряд характеристических функций, но обычно в термодинамике чаще всего используются четыре:
также являются характеристическими. Можно записать ещё целый ряд характеристических функций, но обычно в термодинамике чаще всего используются четыре:
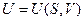 ,
,
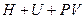 , (**)
, (**)
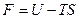 ,
,
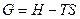 .
.
Используя формулы (*) и (**) запишем дифференциалы этих функций и определим стандартные переменныесоответствующих характеристических функций:
Энтальпия Н.
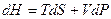 ,
,
Характеристическая функция 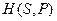 .
.
Свободная энергия Гельмгольца F.
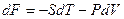 .
.
Характеристическая функция 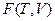 .
.
Свободная энергия Гиббса G.
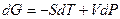 .
.
Характеристическая функция 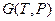 .
.
Функции 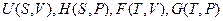 называют также термодинамическими потенциалами. Дадим определение термодинамического потенциала.
называют также термодинамическими потенциалами. Дадим определение термодинамического потенциала.
Термодинамическим потенциалом называется характеристическая функция, убыль которой в обратимом процессе, идущем при постоянстве значений соответствующей пары параметров, равна максимальной полезной работе.
Термодинамические потенциалы стремятся к минимуму при движении системы к равновесию. Перепишем компактно выражения дифференциалов четырёх термодинамических потенциалов:
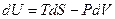 ,
,
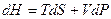 , (***)
, (***)
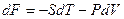 ,
,
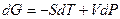 .
.
Формулы (***) составляют основу для получения термодинамических соотношений, которые связывают термодинамические величины друг с другом и с экспериментально определяемыми параметрами. Такие соотношения можно получать различными способами. Например, имеется выражение для полного дифференциала вида
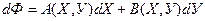
тогда справедливы следующие уравнения:
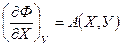 ,
, 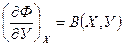 ,
,
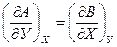
Используя () и () можно получить целый ряд полезных соотношений между термодинамическими величинами.
Энтропию обычно рассматривают как функцию переменных  ;
; 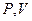 или
или 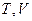 . Записав выражение для полного дифференциала, находят соотношения между энтропией и экспериментально определяемыми параметрами системы.
. Записав выражение для полного дифференциала, находят соотношения между энтропией и экспериментально определяемыми параметрами системы.
Дата добавления: 2016-07-18; просмотров: 2971;











