Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа Температура и ее измерение. Абсолютная температура.
Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. Идеальным принято считать газ, если: а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела; б) газ очень, разрежен, т. е. расстояние между молекулами намного больше размеров самих молекул; в) тепловое равновесие по всему объему достигается мгновенно. Условия, необходимые для того, чтобы реальный газ обрел свойства идеального, осуществляются при соответствующем разрежении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных. Основными параметрами идеального газа являются давление, объем и температура.
Одним из первых и важных успехов МКТ было Качественное и количественное объяснение давления газа на стенки сосуда. Качественное объяснение заключается и том, что молекулы газа при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела и передают свои импульсы стенкам сосуда.
На основании использования основных положений молекулярно-кинетической теории было получено основное уравнение МКТ идеального газа, которое выглядит так: 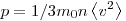 , где
, где 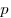 — давление идеального газа,
— давление идеального газа, 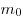 — масса молекулы,
— масса молекулы, 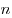 — концентрации молекул,
— концентрации молекул, 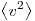 — среднее значение квадрата скоростей молекул. Если представить себе фантастическую ситуацию, в которой нам известны скорости всех молекул и единице объема, то
— среднее значение квадрата скоростей молекул. Если представить себе фантастическую ситуацию, в которой нам известны скорости всех молекул и единице объема, то 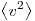 можно было бы вычислить по формуле
можно было бы вычислить по формуле
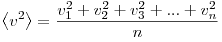
Величина 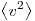 позволяет ввести представление о сродной кинетической энергии поступательного движения молекул идеального газа
позволяет ввести представление о сродной кинетической энергии поступательного движения молекул идеального газа 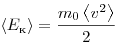 . Тогда основное уравнение МКТ идеального газа можно записать в виде:
. Тогда основное уравнение МКТ идеального газа можно записать в виде: 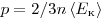 .
.
Однако, измерив только давление газа, невозможно узнать ни среднее значение кинетической энергии молекул по отдельности, ни их концентрацию. Следовательно, для нахождения микроскопических параметром газа нужно измерение еще какой-то физической величины, связанной со средней кинетической энергией молекул. Такой величиной является температура. Температура — скалярная физическая величина, описывающая состояние термодинамического равновесия (состояния, при котором не происходит изменения микроскопических параметров). Как термодинамическая величина температура характеризует тепловое состояние системы и измеряется степенью его отклонения от принятого за нулевое, как молекулярно-кинетическая величина — характеризует интенсивность хаотического движения молекул, измеряется их средней кинетической энергией: 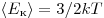 где
где 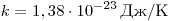 и называется постоянной Больцмана.
и называется постоянной Больцмана.
Температура всех частей изолированной системы находящейся в равновесии, одинакова. Измеряется температура термометрами в градусах различных температурных шкал. Существует абсолютная термодинамическая шкала (шкала Кельвина) и различные эмпирические шкалы, которые отличаются начальными точками. До введения абсолютной шкалы температур в практике широкое распространение получила шкала Цельсия (за О°С принята точка замерзания воды, за 100°С принята точка кипения воды при нормальном атмосферном давлении).
Единица температуры по абсолютной шкале называется Кельвином и выбрана равной одному градусу по шкале Цельсия 1 К = 1 °С. В шкале Кельвина за нуль принят абсолютный нуль температур, т. е. температура, при которой давление идеального газа при постоянном объеме равно нулю. Вычисления дают результат, что абсолютный нуль температуры равен -273 °С. Таким образом, между абсолютной шкалой температур и шкалой Цельсия существует связь Т = t °С + 273. Абсолютный нуль температуры недостижим, так как любое охлаждение основано на испарении молекул с поверхности, а при приближении к абсолютному нулю скорость поступательного движения молекул настолько замедляется, что испарение практически прекращается. Теоретически при абсолютном нуле скорость поступательного движения молекул равна нулю, т.е. прекращается тепловое движение молекул.
Распространенные ошибки:
1. Не всегда правильно объясняют экзаменуемые различие между идеальными и реальными газами. Были, например, такие ответы: «Идеальный газ — это реальный газ без примесей», «Идеальный газ — это реальный газ при низкой температуре» и т. п.
Слово «идеальный» означает «воображаемый, реально не существующий». Реальный газ отличается от идеального наличием взаимодействия молекул. При малых плотностях в нем преобладают силы притяжения, что приводит к появлению дополнительного давления: газ как бы сжимает сам себя. При больших плотностях действуют силы отталкивания, вследствие чего молекула не допускает проникновения других молекул в занимаемый ею объем. Пренебрегать собственным объемом молекул реального газа нельзя.
При не слишком высоком давлении (например, при атмосферном) и не слишком низкой температуре (например, при комнатной) реальный газ с достаточной степенью точности подчиняется законам идеального газа.
Дата добавления: 2016-07-18; просмотров: 1902;











