Химический синтез ДНК
В настоящее время достаточно быстро можно синтезировать искусственные фрагменты нуклеиновых кислот разной длины и любого состава (такие фрагменты называются олигонуклеотидами), а затем соединить их в более длинные цепи с помощью специальных ферментов. Полученные таким образом гены и их фрагменты широко используются в генетической инженерии, биотехнологии, а также для диагностики инфекционных и генетических заболеваний. Так химически синтезированные олигонуклеотиды можно использовать:
• для конструирования целых генов или их фрагментов
• для амплификации специфических фрагментов ДНК
• для направленных мутаций изолированных ДНК
• в качестве зондов при гибридизации
• в качестве линкеров, облегчающих клонирование.
Напомним, что нуклеиновые кислоты являются нерегулярными биополимерами, состоящими из мономерных структур – нуклеотидов (рис. 29).
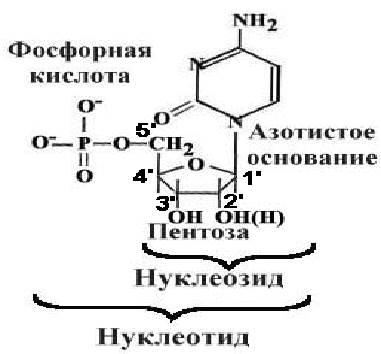
Рис. 29. Состав и строение нуклеотида.
Таким образом:
Нуклеотид = нуклеозид + фосфорная кислота = азотистое основание+ пентоза+фосфорная кислота.
В РНК пентоза - рибоза. В ДНК - дезоксирибоза.
В состав нуклеиновых кислот и олигонуклеотидов входят пять нуклеотидов, отличающихся между собой строением азотистого гетероцикла. Три из них - производные аденина (А), гуанина (G) и цитозина (С) входят в состав и ДНК и РНК, производное тимина (Т) - только в ДНК, урацила (U) - только в РНК. Нуклеотиды в отличие от нуклеозидов содержат остаток фосфорной кислоты. Нуклеотиды соединяются друг с другом в полимерную цепочку с помощью фосфодиэфирных связей (рис. 30). Азотистые основания не принимают участия в соединении нуклеотидов одной цепи.
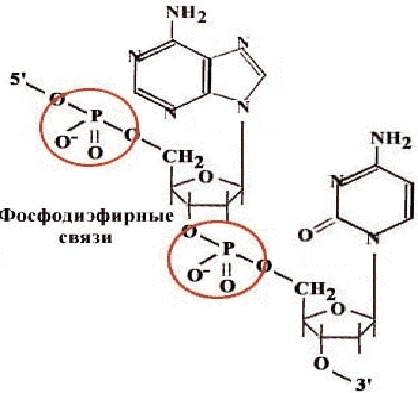
Рис. 30. Схема соединения нуклеотидов с помощью фосфодиэфирной связи
Задачей химического синтеза нуклеиновых кислот является соединение входящих в их состав мономеров в строго определенной последовательности. Для образования межнуклеотидной связи должно произойти соединение двух нуклеотидов с отщеплением молекулы воды. Образующийся димер реагирует далее со следующим мономером (нуклеотидом) с образованием тримера и т.д. Для проведения этих реакций необходимо выполнение следующих условий.
1. Нужно добиться селективности соединения мономерных звеньев. Например, гидроксильная группа первого нуклеотида должна взаимодействовать с фосфатным остатком второго, но не наоборот, т.к. одним из принципов построения полинуклеотидов в природе является униполярность, т.е. соединение мономеров всегда в направлении 5' →3'.Для этого фрагменты, которые не участвуют в реакции, нужно блокировать с помощью специальных защитных групп.
2. Сами по себе гидроксильная и фосфатная группы в нуклеотидах не реагируют друг с другом. Для проведения конденсации мономеров нужно активировать фосфатную группу.
3. Поскольку синтез проводится в несколько стадий, каждая реакция должна проходить с очень высоким выходом.
4. Все процессы - введение и удаление защитных групп, активация и конденсация - должны проводиться в мягких условиях, то есть без использования высоких температур, а также концентрированных растворов кислот или щелочей, что могло бы привести к образованию побочных продуктов и разрушению имеющихся и вновь образованных химических связей.
В настоящее время разработано большое число методов синтеза олигонуклеотидов, удовлетворяющих этим условиям, подобраны удобные защитные группы и предложены способы активации фосфатной группы.
Синтез протяженных фрагментов нуклеиновых кислот состоит из большого числа стадий. После проведения каждой химической реакции нужно выделить полученный продукт, очистив его от не вступивших в реакцию исходных веществ и других примесей. Это делает процесс длительным и трудоемким, а также приводит к значительным потерям на каждой стадии выделения.
Американский ученый Роберт Меррифилд в 1962 году предложил оригинальную идею твердофазного метода синтеза, которая позволила резко упростить и ускорить проведение процесса. Идея заключается в том, что первый мономер (нуклеозид) присоединяют к нерастворимому полимерному носителю (твердой фазе), который помещают в колонку-реактор. Раствор, содержащий второй мономер и другие необходимые реагенты, пропускают через колонку. При этом образовавшийся продукт реакции также оказывается присоединенным к твердой фазе. Затем колонку промывают растворителем для удаления непрореагировавших веществ и побочных продуктов, после чего через реактор пропускают следующий мономер, повторяя процедуру многократно до завершения синтеза желаемого продукта. Таким образом, растущая полимерная цепь в процессе синтеза закреплена на твердой фазе, и все реакции с другими компонентами, находящимися в растворе, протекают на поверхности носителя. Этот прием позволяет заменить сложные и трудоемкие процедуры разделения и очистки промежуточных продуктов элементарными операциями промывки полимера.
Синтез включает в себя несколько принципиальных стадий.
Стадия 1. Получение защищенных мономеров, которые являются исходными блоками для построения цепочки олигонуклеотида. Для этого те фрагменты молекул, которые не должны подвергаться химическим превращениям, блокируют специальными защитными группами.
Стадия 2. Присоединение концевого мономера (защищенного нуклеозида) к полимерному носителю. Гранулы носителя с присоединенным концевым мономером вносят в колонку-реактор.
Стадия 3. Удаление защитной группы с концевого мономера. Для этого через колонку пропускают раствор реагента, вызывающего отщепление защитной группы.
Стадия 4. Проведение конденсации, для чего через колонку пропускают раствор второго мономера в смеси с активирующим реагентом.
Стадии 3 и 4 повторяют многократно до получения биополимера необходимой длины. Затем проводят стадии 5 и 6.
Стадия 5. Обработка носителя реагентами, приводящими к отщеплению синтезированного продукта от твердой фазы и удалению всех защитных групп.
Стадия 6. Выделение и очистка синтезированного фрагмента нуклеиновой кислоты с помощью различных хроматографических и электрофоретических методов. (Из-за неполноты протекания реакций к концу синтеза на носителе накапливаются более короткие фрагменты цепи, поэтому необходима тщательная очистка конечного продукта).
Основной вклад в развитие олигонуклеотидного синтеза внес Г. Корана, осуществивший в начале 60-х годов химический синтез фрагментов нуклеиновых кислот заданной последовательности и получивший за эту работу в 1968 году Нобелевскую премию. В 1970 году он впервые синтезировал полный ген аланиновой транспортной РНК.
В 1975 году Р. Летсингер предложил новый метод образования межнуклеотидной связи, на основании которого в начале 80-х годов М. Карузерс разработал так называемый твердофазный амидофосфитный или фосфорамидитный метод синтеза олигонуклеотидов. С этого времени начались бурное развитие этого метода и его автоматизация.
Исходные строительные блоки для синтеза олигонуклеотида – модифицированные дезоксирибонуклеозиды (амидофосфиты или фосфарамидиты). Эти соединения, содержащие трехвалентный фосфор, являются более активными по сравнению с производными пятивалентного фосфора (рис.31).
Амидофосфитные мономеры получают из защищенных нуклеозидов. Модификация состоит в присоединении к аминогруппам дезоксиаденозина и дезоксицидина бензольной группы, а к аминогруппе дезоксигуанозина – изобутиральной. Тимидин, у которого аминогруппа отсутствует, не модифицируют. Такая модификация необходима для защиты нуклеозидов от нежелательных побочных эффектов.
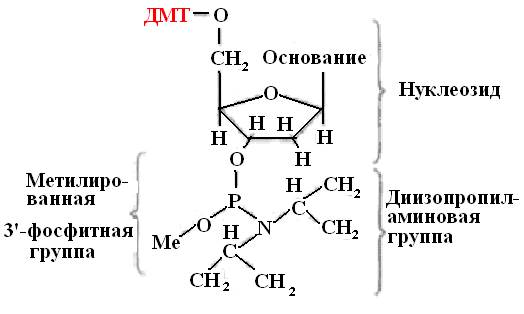
Рис. 31. Структурная формула фосфорамидита
Такие производные всех четырех оснований – A,T,G и C используются для химического синтеза ДНК.
ДМТ – диметокситритил
Ме – метильная группа
Синтез осуществляется в твердой фазе, растущая цепь ДНК фиксируется на твердом носителе, что позволяет проводить все реакции в одной емкости, легко отмывать после каждого этапа ненужные реагенты и добавлять новые в количестве, оптимальном для полного протекания реакции. Первый нуклеозид фиксируют на твердом носителе с помощью химического спейсера (рис 32). Обычно это пористые стеклянные шарики с порами одинакового размера.
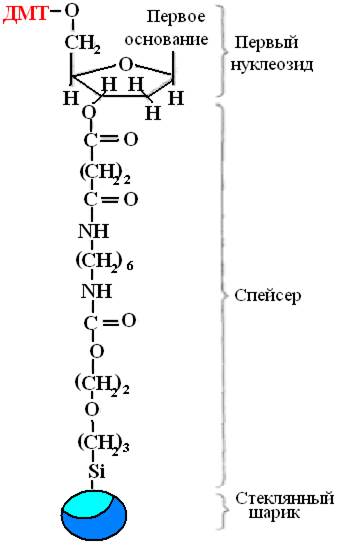
Рис. 32. Первый нуклеозид, фиксированный с помощью спейсера.
После n циклов, проведенных по схеме синтеза (рис. 33), образуется одноцепочечный фрагмент ДНК из n+1 нуклеотида
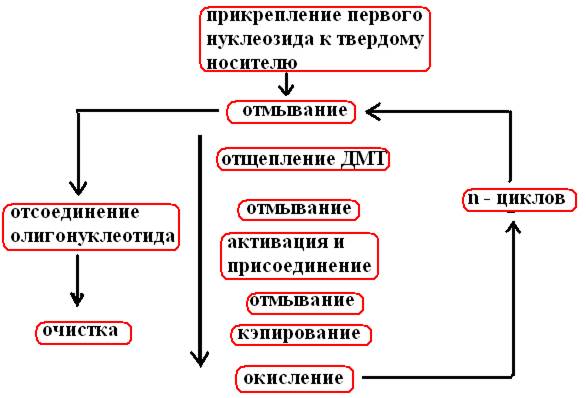
Рис. 33. Схема химического синтеза олигонуклеотида
Цикл начинается после присоединения первого нуклеозида к стеклянному шарику
• промывают безводным растворителем (ацетонитрил), остатки которого удаляют продуванием аргона
• промывают ТХУ (трихлоруксусная кислота) для отщепления ДМТ (детритилирование)
• опять промывают растворителем и ТХУ, продувают аргон и на этом этапе вводят следующий нуклеозид в виде фосфоримидита и тетразол, который активирует фосфорамидит, несвязавшиеся реагенты удаляют продуванием аргона.
! Поскольку по окончании первого этапа не все фиксированные на носителе нуклеозиды оказываются связанными с фосфорамидитом, необходимо предотвратить их взаимодействие с нуклеозидом, добавленным на втором этапе. Для этого непрореагировавшую 5’–ОН группу ацетилируют с помощью уксусного ангидрида и диметиламинопиридина (кэппирование).
!! Нестабильную фосфиттриэфирную связь, образовавшуюся на втором этапе между нуклеотидами с помощью иодной смеси окисляют до пятивалентного фосфаттриэфира.
Все описанные операции проводят до тех пор, пока к растущей цепи в соответствии с программой не присоединится последний нуклеозид.
!!! Метильные группы удаляют с помощью химической обработки непосредственно в реакционной колонке. Затем отсоединяют олигонуклеотиды от спейсерной молекулы вместе с 3’ –ОН концом и элюируют их из колонки; затем последовательно удаляют бензоильные, изобутиральные и ДМТ-группы. 5’ –конец цепи фосфорилируют ферментативным (полинуклеотидкиназа+АТФ) или химическим методом
Важным преимуществом твердофазного метода синтеза является простота операций. Процесс синтеза состоит из повторяющихся стадий пропускания защищенных мономеров, реагентов и растворителей через колонку с полимерным носителем, к которому присоединена растущая цепь. Это делает возможной автоматизацию процесса.
Автоматические синтезаторы включают в себя реактор, содержащий носитель с присоединенным к нему первым мономером, и сосуды с необходимыми мономерами, реагентами и растворителями. С помощью насоса растворы из этих сосудов поочередно подаются в реактор в соответствии с имеющейся программой и заданной последовательностью синтезируемого фрагмента белка или нуклеиновой кислоты. В настоящее время автоматические синтезаторы пептидов и олигонуклеотидов выпускают различные, в том числе и отечественные, фирмы.
Секвенирование ДНК
Исчерпывающую информацию о молекуле ДНК можно получить, только определив ее нуклеотидную последовательность. Эта процедура называется секвенированием (от англ. sequence). Так, секвенировав ген, т.е. установив последовательность нуклеотидов определенного участка ДНК, часто удается установить его функцию, сравнив эту нуклеотидную последовательность с таковыми для генов, функция которых уже известна. Без данных о нуклеотидной последовательности невозможно проводить исследования по молекулярному клонированию, а также создание экспрессионных рекомбинантных ДНК.
Работы по секвенированию ДНК довольно дорогостоящие. Они требуют специального прецизионного оборудования, особо чистых химических реактивов и биологических препаратов, а также специалистов с высокой профессиональной подготовкой. Потенциал биотехнологии будет реализован в полной мере только тогда, когда ее инструментарий (в том числе и секвенирование геномов) станет столь же доступным и недорогим, как персональные компьютеры. Чтобы снизить стоимость процедуры секвенирования, разработчики новых методов стараются сократить число подготовительных этапов, до предела миниатюризировать оборудование и проводить секвенирование миллионов молекул одновременно
Прежде, чем приступить к описанию методов секвенирования, следует вспомнить основные моменты воспроизведения нуклеотидных последовательностей ДНК, т.е. некоторые принципиальные этапы репликации ДНК.
ДНК клетки, приступающая к делению, претерпевает кардинальные изменения: двойная спираль раскручивается, цепи расходятся. На каждой цепи начинается синтез комплементарных полинуклеотидов, на одной — непрерывный, на второй прерывистый. Его катализирует фермент под названием ДНК-зависимая ДНК-полимераза; другой фермент, ДНК-лигаза, сшивает полинуклеотидные фрагменты в непрерывную цепь. Так из одной молекулы ДНК образуются две.
Многие методы секвенирования ДНК основаны на взаимной комплементарности цепей этой молекулы. Генетический алфавит состоит всего из четырех букв — азотистых оснований аденина (А), цитозина (С), гуанина (G) и тимина (Т). Основания противоположных цепей молекулы ДНК соединяются в соответствии с правилом комплементарности: А образует пару с Т, а С — с G. В результате такого взаимодействия образуется хорошо известная двойная спираль — структура, напоминающая винтовую лестницу (рис. 34).
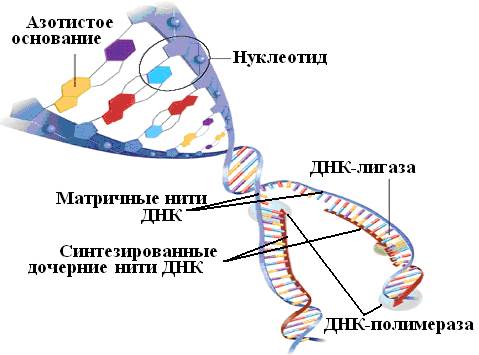
Рис. 34. Схема синтеза дочерних нуклеотидных цепей на обеих цепях ДНК
Живые организмы используют принцип комплементарности при копировании своего генетического материала (репликация) и устранения повреждений в нем (репарация). Он же лежит в основе амплификации (см. ПЦР) целевых фрагментов ДНК и их последующего секвенирования с помощью метода, разработанного в конце 1970-х гг. Ф. Сангером.
Дата добавления: 2016-07-18; просмотров: 7561;











