Секвенирование ДНК по Сангеру
Перед секвенированием по методу Сангера молекулу ДНК разрезают на фрагменты и клонируют в Escherichia coli. Выделенные из бактериальных клеток фрагменты многократно амплифицируют с помощью полимеразной цепной реакции (рис. 35), как описано в соответствующем разделе данного пособия.
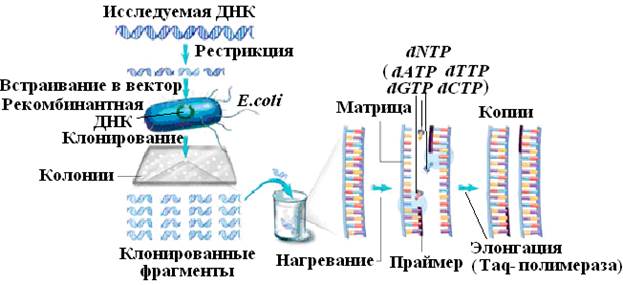
Рис. 35. Схема подготовки фрагментов ДНК с помощью ПЦР для секвенирования
Описание в тексте.
Образец ДНК нагревают до температуры, при которой происходит расхождение цепей. Затем в реакционную смесь добавляют дезоксинуклеозидтрифосфаты (dNTP) и праймер — короткий олигонуклеотид, комплементарный небольшому сегменту ДНК-матрицы. Он гибридизуется с этим сегментом, и ДНК-полимераза последовательно присоединяет к его концу dNTP, комплементарные нуклеотидам копируемой цепи. Процесс многократно повторяют, пока не получат миллионы копий каждого фрагмента.
Раствор с одноцепочечными фрагментами и праймерами распределяют по четырем пробиркам, в каждую из которых добавлены четыре разные dNTP и один из дидезоксинуклеозидтрифосфатов (ddNTP). Дидезоксинуклеотид – это полученный искусственным путем нуклеотид, лишенный 2’ – и 3’ – ОН групп при углеродных атомах сахарного кольца. При присоединении такого нуклеотида во время роста полинуклеотидной цепи синтез останавливается из-за отсутствия 3’ – ОН, к которому Днк-полимераза ковалентно присоединяет фосфатную группу следующего комплементарного матрице нуклеотида. Остановка синтеза ДНК – ключевой этап дидезокси-метода (рис. 36).
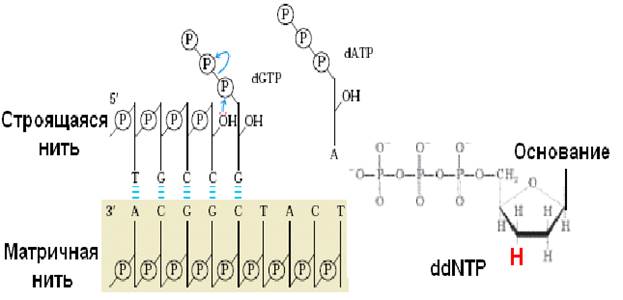
Рис. 36. Остановка синтеза полинуклеотидной цепи с помощью ddNTP
Удлинение гибридизовавшегося с ДНК-фрагментом праймера происходит до тех пор, пока в цепь не включится один из ddNTP (ddATP, ddTTP, ddCTP и ddGTP). В этом месте синтез останавливается, и в результате в каждой из пробирок образуется уникальный набор отрицательно заряженных фрагментов разной длины, оканчивающихся одним из ddNTP.
В случае ручного секвенирования для детектирования синтезированных фрагментов используют радиоактивномеченные dNTP (чаще всего α-Р32 dATP) в составе dNTP во все четырех пробирках, в которых осуществляется ПЦР. В пробирки добавляют формамид, чтобы обеспечить расхождение цепей, и проводят электрофорез в полиакриламидном геле на четырех дорожках. Это позволяет разделить одноцепочечные фрагменты ДНК, даже если они различаются по длине всего на один нуклеотид. На радиоавтографе обнаруживается набор полос, отвечающих меченым фрагментам ДНК, сопоставление которых позволяет прямо “прочитать” нуклеотидную последовательность секвенируемого сегмента ДНК. Нуклеотидная последовательность считывается с радиоавтографа снизу вверх (рис. 37).
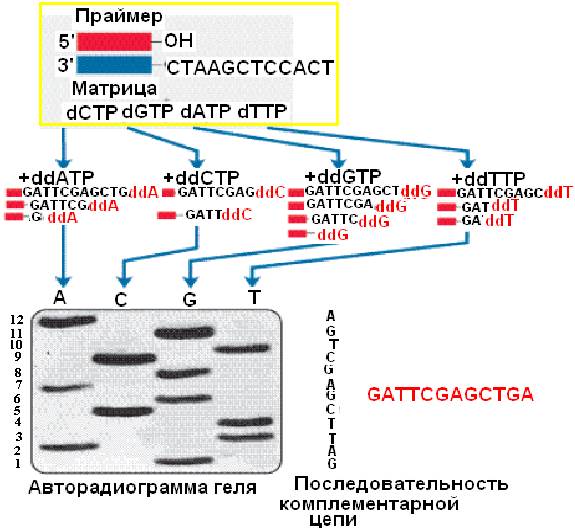
Рис. 37. Визуализация и протоколирование результатов секвенирования с применением изотопной метки.
При проведении автоматического секвенирования, т. е. при использовании специальных приборов – секвенаторов, применяют другие системы детекции. Так, например, каждый из четырех ddNTP метится с помощью специфического флуорофора, в результате чего в каждой из четырех пробирок продукты ПЦР будут иметь в своем составе разный флуорофор (рис. 38).
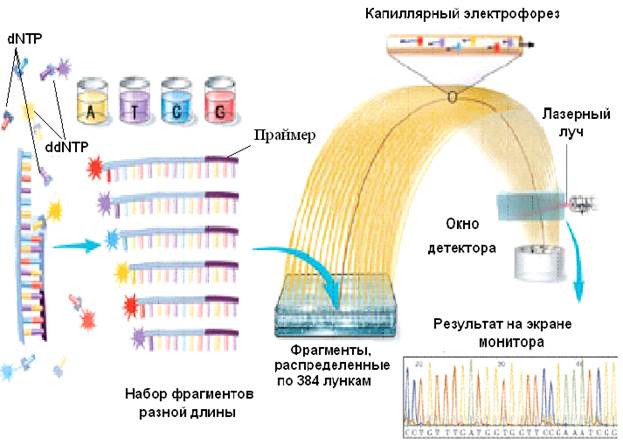
Рис. 38. Принципиальная схема определения первичной последовательности ДНК с помощью автоматического секвенатора.
В результате последнего раунда дупликации, проводимого в особых условиях, получают набор копий фрагментов разной длины, каждый из которых заканчивается флуоресцентно меченым нуклеотидом. Фрагменты разделяют по длине с помощью электрофореза, регистрируют световой сигнал от каждого из них по мере прохождения через детектор и получают нуклеотидную последовательность исходной цепи.
К достоинствам метода Сангера относятся его относительная простота и высокая точность, но, несмотря на последующие усовершенствования, он остается дорогим и трудоемким. Задача создателей альтернативных путей секвенирования состояла в повышении скорости процедуры и ее удешевлении. Для этого нужно было исключить этапы разделения, занимающие много времени, миниатюризировать всю систему, сохранив при этом возможность прочитывать последовательности миллионов фрагментов.
Следует также упомянуть и другие методы секвенирования при помощи биосинтеза, основанные на тех стадиях упомянутого процесса, которые протекают на одиночной цепи секвенируемой ДНК. В одном из таких подходов регистрируется момент присоединения к праймеру, гибридизовавшемуся с ДНК-матрицей, комплементарного нуклеотида (удлинение цепи). В другом - момент сшивания лигазой праймера с олигонуклеотидным зондом, содержащего известный нуклеотид в определенной позиции.
Существуют разные способы регистрации данных процессов, но обычно используется один из двух типов сигналов. Если меткой служит присоединенный к нуклеотиду флуорофор, как было рассмотрено выше, то регистрируется испускаемый им свет определенной длины волны. Флуоресцентное детектирование применяют при секвенировании как методом удлинения цепи, так и методом лигирования.
Другой подход основан на регистрации биолюминесценции, которая инициируется связыванием с белком люциферазой (его синтезируют хорошо знакомые нам светлячки) пирофосфата, высвобождаемого после присоединения к праймеру очередного нуклеотида.
Один из наиболее перспективных методов секвенирования использует для идентификации оснований в молекуле ДНК совсем другой принцип — физическое различие между четырьмя нуклеотидами, А, Т, G и С (рис. 39).
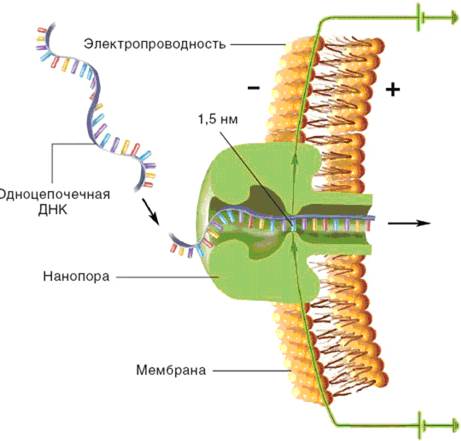
Рис. 39. Схема секвенирования с применением нанопор
Отрицательно заряженная одноцепочечная ДНК проходит через нанометровую пору в мембране, наружная поверхность которой несет отрицательный заряд, а внутренняя — положительный.
Одноцепочечную ДНК протягивают через пору диаметром 1,5 нм, пронизывающую мембрану, и регистрируют изменение электропроводности последней по мере поочередного прохождения нуклеотидов. Каждому типу основания соответствует свое изменение электропроводности, что и позволяет прочитать нуклеотидную последовательность цепи.
Дата добавления: 2016-07-18; просмотров: 3957;











