Задания к разделу 1
Образец выполнения домашнего задания
Строение атома
Задание 1. а)Укажите численные значения главного и орбитального квантовых чисел данных подуровней, рассчитайте последовательность их заполнения: 5p, 7p, 7s.
Решение. 5p 7p 7s
Значение n5 7 7
Значениеl 1 1 0
Сумма (n+l) 6 8 7
Последовательность заполнения (на основании правил Клечковского) :
1 – 5p; 2 – 7s; 3 – 7p.
б) Распределите по квантовым ячейкам валентные электроны 2s2 2p4, определите химический элемент и его положение в системе Д.И. Менделеева (номер периода, группа, подгруппа).
Решение.Валентныеэлектроны по квантовым ячейкам распределены следующим образом: 2s2 2p4
| ¯ | ¯ | | |
Предложенный элемент кислород расположен во втором периоде, шестой группе, главной подгруппе Периодической системы Д.И. Менделеева.
в) Напишите электронные формулы атомов и ионов, укажите положение их в системе Д.И. Менделеева (номер периода, группа, подгруппа): K, Zn2+.
Решение. Электронная формула химического элемента калия следующая: 1s22s22p63s23p64s1. Он расположен в четвертом периоде, первой группе, главной подгруппе Периодической системы Д.И. Менделеева. Электронная формула катиона Zn2+: 1s22s22p63s23p63d10. Химический элемент цинк расположен в четвертом периоде, второй группе, побочной подгруппе.
Аналогично оформлять решение всех заданий.
СТРОЕНИЕ АТОМА
В Периодической системе Д. И. Менделеева (табл. П.4) представлены все известные элементы. Она состоит из семи периодов (1-3 - малые, 4-7 - большие), 8 групп. Каждая группа разделена на главную и побочную подгруппы. Главная подгруппа содержит элементы малых и больших периодов, а побочная – только больших.
Пример 1. Укажите в Периодической системе Д.И. Менделеева положение (номер периода, номер группы, главная или побочная подгруппа) атома элемента с зарядом ядра 85.
Решение.Элемент (85At) находится в 6-м периоде, 7-й группе, главной подгруппе.
Атомы элементов состоят из положительно заряженного ядра (протонов и нейтронов) и электронов. Количество электронов равно порядковому номеру элемента. Состояние электрона в атоме характеризуется квантовыми числами n,l, ml и ms, которые называются соответственно главное, орбитальное, магнитное и спиновое.
Порядок заполнения орбиталей электронами определяется следующими правилами В. Клечковского:
· заполнение происходит в порядке увеличения суммы (n + l);
· при одинаковых значениях этой суммы в первую очередь заполняется подуровень с меньшим значением главного квантового числа n.
Последовательность заполнения электронами энергетических уровней и подуровней в многоэлектронных атомах имеет вид
1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <5d 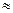 4f <6p <7s <6d
4f <6p <7s <6d 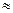 5f <7p.
5f <7p.
Пример 2. Используя правила Клечковского, рассчитайте, какой подуровень раньше заполняется электронами 4р или 5s.
Решение. Для 4р-подуровня Sn + l = 4 + 1 = 5; для 5s-подуровня Sn + l = 5 + 0 = 5. Так как сумма одинакова, то в первую очередь заполняется подуровень с меньшим значением n, т. е. 4р.
Пример 3.По распределению валентных электронов -3d54s2 определите, какой это элемент, укажите его символ и напишите полную электронную формулу.
Решение.Значению главного квантового числа последнего энергетического уровня соответствует номер периода, следовательно, элемент находится в 4-м периоде. Сумма валентных электронов показывает номергруппы, в которой находится элемент, в данном случае номер группы 7. Так как валентные электроны находятся на d-подуровне, то это элемент побочной подгруппы: 25Mn 1s22s22p63s23p63d54s2.
Пример 4. Напишите полную электронную формулу атома элемента с зарядом ядра 22.
Решение. 22Ti 1s22s22p63s23p63d24s2.
Пример 5. Напишите полные электронные формулы ионов Fq, Sn2+.
Решение. При образовании отрицательно заряженного иона нейтральный атом элемента принимает электроны: F0 + 1ē = Fq;электронная формула иона9Fq1s22s22p6. Положительно заряженный ион получается, когда нейтральный атом элемента отдает электроны: Sn0 - 2ē = Sn2+ ; электронная формула иона 50Sn2+ 1s22s22p63s23p6 3d104s24p64d105s25p0.
Задания к разделу 1
Каждое задание содержит три вопроса (а,б,в).
| Номер зада-ния | а)Укажите числен-ные значения главного и орбитального кван-товых чисел данных подуровней, рассчитайте последовательность их заполнения | б)Распределите по квантовым ячейкам валентные электроны, определите химический элемент и его поло-жение в системе Д.И.Менделеева (номер периода, группа, под-группа) | в)Напишите элек-тронные формулы предложенных ато-мов и ионов, укажите положе-ние их в системе Д.И.Менделеева (номер периода, группа, подгруппа) |
| 3p; 4s; 2p | 3d 1 4s 2 | Fe, Na + | |
| 3d; 4p; 3p | 3d 2 4s 2 | Co, Cl — | |
| 5d; 4p; 4d | 3d 3 4s 2 | Ni, Ba 2+ | |
| 3d; 4f; 5s | 3d 5 4s 1 | Zn, Ca 2+ | |
| 4d; 4s; 5s | 4d 5 5s 2 | Sn, S 2— | |
| 6s; 4p; 4f | 3d 6 4s 2 | W, In 3+ | |
| 3d; 5s; 7p | 3d 7 4s 2 | S, La 3+ | |
| 4d; 6s; 5d | 3d 8 4s 2 | F, Tl 3+ | |
| 4p; 5p; 4f | 3d 10 4s 1 | Br, Zr 4+ | |
| 3d; 3p; 2s | 3d 10 4s 2 | Al, Hg 2+ | |
| 5d; 3s; 6s | 4s 2 4p 1 | Pb, Au 3+ | |
| 6d; 4f; 5p | 4s 2 4p 2 | Ge, Ag + | |
| 5d; 3p; 4d | 4 s 2 4p 3 | Ga, Sb 3+ | |
| 7s; 6p; 4d | 4s 2 4p 4 | N, Bi 3+ | |
| 5d; 4p; 3d | 4s 2 4p 5 | Cl, Pb 2+ | |
| 5s; 6s; 4p | 4s 2 4p 6 | Y, Hf 4+ | |
| 6p; 5f; 6d | 5d 7 6 s 2 | Zr, At — | |
| 5d; 5s; 4f | 5d 10 6 s 2 | Ta, Ga 3+ | |
| 3s; 4d; 3p | 5d 3 6 s 2 | Cr, Se 2— | |
| 5f; 4d; 4s | 5d 5 6 s 2 | Мо, Cu 2+ |
Дата добавления: 2016-07-11; просмотров: 6726;











