Окислительно-восстановительные потенциалы (Е)
| Компоненты | Характеристика | Е, В |
| Комплекс I (НАДН: СоQ-оксидоредуктаза) | ||
| НАДН | Никотинамидадениндинуклеотид восстановленный | – 0,320 |
| ФМН | Флавинмононуклеотид – кофермент дегидрогеназы, окис- ляющей эндогенный НАДН | – 0,070 – 0,300 |
| FeSN1 | Железосерные центры (белки): | – 0,305 |
| FeSN2 | N1 – 2Fe2S; N2, N3 – 4Fe4S | – 0,245 |
| FeSNI | – 0,020 | |
| Комплекс II (сукцинат: убихинон-оксидоредуктаза) | ||
| ФАД | Флавинадениндинуклеотид – кофермент сукцинатдегидро- геназы | – 0,045 |
| FeSSI | Железосерные белки: | – 0,007 |
| FeSS2 | S1, S2 – 2FeS-типа | (0,230) |
| FeSS3 | S3 – 4Fe4S-типа | + 0,080 |
| Q Убихинон – липидорастворимый одно- и двухэлектронный переносчик + 0,070 | ||
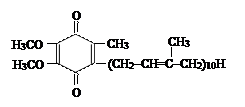
| ||
| Комплекс III (убихинол: цитохром с-оксидоредуктаза) | ||
| Цитохромы | Гемопротеины, в которых гем связан с белком нековалентно | |
| b556 | + 0,075 | |
| b560 | + 0,080 | |
| Цит. с1 | Цитохром с552 – гемопротеин; гем ковалентно связан с бел- ком | + 0,235 |
| FeSR | Железосерный белок Риске (2Fe2S) | + 0,280 |
| Цит. с | Цитохром с550 – гемопротеин; гем ковалентно связан с белком; водорастворим | + 0,235 |
| Комплекс IV (цитохром с: кислород – оксидоредуктаза; цитохромоксидаза | ||
| Цит. а | Цитохром а – гемопротеин, гем которого нековалентно связан с белком | + 0,190 + 0,210 |
| CuА | Атом меди, функционирующий с цит. а как редокс- компонент комплекса | |
| Цит. а3 | Цитохром а3 – гемопротеин; способен взаимодействовать с кислородом | + 0,385 |
| CuB | Атом меди, функционирующий с цит. а3 при образовании комплекса с кислородом | |
| О2, Н2О | 1/2О2 + 2Н+ + 2е– ↔ Н2О | + 0,816 |
Комплекс I осуществляет перенос электронов от НАДН к убихинону Q. Его субстратом служит молекула внутримитохондриального НАДН, который восстанавливается в цикле Кребса. В состав комплекса входит флавиновая ФМН-зависимая НАДН: убихинон-оксидоредуктаза, содержащая три железосерных центра (FeSN1–3). При встраивании в искусственную фосфолипидную мембраны этот комплекс функционирует как протонная помпа.
Комплекс II катализирует окисление сукцината убихиноном. Эту функцию выполняет флавиновая (ФАД-зависимая) сукцинат: убихинон-оксидоредуктаза, в состав которой также входят три железосерных центра (FeS1–3).
Комплекс III переносит электроны восстановленного убихинона к цитохрому с1, т. е. функционирует как убихинон: цитохром с-оксидоредуктаза. В своем составе он содержит цитохромы b556, b560, с1 и железосерный белок Риске. По структуре и функции он подобен цитохромному комплексу b6 – f тилакоидов хлоропластов. В присутствии убихинона комплекс III осуществляет активный трансмембранный перенос протонов.
В комплексе IV электроны переносятся от цитохрома с к кислороду, т. е. этот комплекс является цитохром с: кислород-оксидоредуктазой (цитохромоксидаза). В его состав входят четыре редокс-компонента: цитохром а а3 и два атома меди. Цитохром а3 и CuВ способены взаимодействовать с О2, на которые передают электроны от цитохрома а – CuА. Транспорт электронов через комплекс IV связан с активным переносом Н+. Взаимодействие цитохрома а3 – CuВ с О2 подавляется цианидом, азидом и СО. В последнее время показано, что комплексы I, III и IV пересекают внутреннюю мембрану митохондрий.
Все компоненты цепи, за исключением убихинона представляют собой белки с характерными простетическими группами. В состав цепи входят белки трех типов:
– флавопротеины, содержащие в качестве простетичной группы флавинмононкулеотид (ФМН) или флавинадениндинуклеотид (ФАД);
– цитохромы, содержащие в качестве простетичной группы гемы;
– железосеропротеины, в которых простетичная группа состоит из негемового железа,освязанного комплексно с неорганической серой или серой цистеина.
Убихинон – липид, который состоит из бензохинона и длинной гидрофобной изопреноидной боковой цепи (см. табл. 3.1).
Компоненты ЭТЦ классифицируют также как переносчики электронов или переносчики водорода в зависимости от функции, которую они выполняют. Поскольку назначение цепи перенос электронов – это перемещать (или содействовать передаче) электронов от высокоэнергетического восстановителя к кислороду, все компоненты цепи должны быть переносчиками электронов. Однако некоторые из них совместно с электронами переносят и протон (Н+); эти соединения называют переносчиками водорода (это сделано чтобы отличать их от переносчиков ē, которые перемещают только электроны).
Кроме этого, очень важно знать к каким переносчикам относится компонент – к одно- или двухэлектронным ОВ соединениям. В одноэлектронных соединениях окисленная и восстановленная формы отличаются на один электрон; это значит они принимают только один электрон при преобразованиях окисленной формы в восстановленную и отдают один электрон в обратной реакции. У двухэлектронных переносчиков окисленное и восстановленное положения отличаются на два электрона. Флавопротеины и убихинон являются двухэлектронными ОВ соединениями; цитохром – одноэлектронное соединение. Классификация железосерных белков не такая простая, но, вероятно, их правильней рассматривать как одноэлектронные ОВ соединения.
В дыхательной цепи происходит перенос электронной пары по термодинамическому потенциалу на кислород. Перемещается пара электронов, поскольку оба агента НАДН и сукцинат являются двухэлектронными ОВ системами. Это значит, что при окислении НАДН и сукцината до НАД+ и фумарата соответственно в цепь переноса электронов входит два электрона. Эти два электрона затем передаются по цепи компонентов с уменьшающимся электрическим потенциалом, пока не достигнут последнего компонента цепи цитохромоксидазы. Цитохромоксидаза (цит. а и цит. а3) использует эти два ē совместно с протонами для восстановления одного атома кислорода до одной молекулы воды. Таким образом, каждый компонент цепи взаимодействует одновременно с 2 ē. Поэтому для переноса пары ē, полученной одной молекулой убихинона к одному атому кислорода необходимы две молекулы каждого из цитохромов (они функционируют парами).
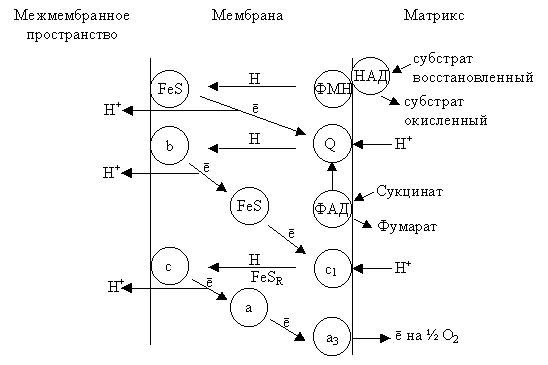
Работа ЭТЦ представлена на рис. 3.6.
|
| Рис. 3.6. Схема функционирования электрон-транспортной цепи в мембране митохондрий |
Пируват, изоцитрат, α-кетаглутарат, малат окисляются с помощью дегидрогеназы, коферментом который является НАД+. Окисление НАДН происходит с помощью НАДН-дегидрогеназы, которая является флавопротеидом; роль простетической группы выполняет ФМН. Протон, который отщепляется от НАДН, переносится с внутренней стороны мембраны на внешнею (ФМНН2), а электроны передаются на убихинон Q. Q, получивший электроны, заряжается отрицательно, захватывает протоны со стромы митохондрии и диффундирует в форме QН2 к цитохрому b. На внешней стороне мембраны QН2 окисляется и отдает электроны цитохрому b, а протон – в межмембранное пространство митохондрии. Через FeSR электрон передается цитохрому с1. Считают, что цитохром с1, получивший электрон, также захватывает ион Н+ со стромы митохондрии и передает ē цитохрому с, а Н+ выбрасывается в межмембранное пространство. В конце ЭТЦ находится цитохромоксидаза, состоящая из цит. а и цит. а3 и катализирующая перенос электронов на кислород воздуха. Когда окисляющим субстратом служит сукцинат, тогда водород переносится на ФАД, а затем на Q.
Таким образом, электрон переходит через цепь ферментов, спускаясь на более низкий энергетический уровень до тех пор, пока не акцептируется молекулярным кислородом. Следовательно, движущей силой транспорта электронов является разность ОВ потенциалов – –0,5 В у дыхательного субстрата и +0,82 В у кислорода воздуха.
Когда при окислении дыхательного субстрата образуется НАДФН, то он окисляется до НАДФ+, и дальше транспорт электронов идет так же, как и при образовании НАДН.
Рассмотренный механизм работы ЭТЦ очевидным образом подтверждает два положения теории В. И. Палладина: ферменты работают в клетке не «врассыпную», а образуют системы; кислород воздуха нужен только для окисления ферментов, а не дыхательного субстрата.
На одних этапах, транспорта от одного переносчика другому передаются совместно протоны и электроны, на других – только электроны. В последнем случае происходит разделение зарядов: Н → Н+ + ē. В результате присоединения электронов, передаваемых по дыхательной цепи, и протонов из внешней водной среды к кислороду воздуха образуется новая молекула воды: 4Н+ + 4ē + О2 → 2Н2О.
Эта вода получила название метаболической. В таких растениях, как суккуленты, выдерживающих засуху благодаря запасанию воды в тканях листьев или стеблей, она играет важную роль в водном балансе организма.
Для функционирования ЭТЦ необходима упорядочность и тесная упаковка молекул. Нарушение в какой-нибудь точке ЭТЦ полностью блокирует транспорт электронов.
Дыхательная ЭТЦ служит для передачи электронов от восстановленных субстратов на кислород, что сопровождается трансмембранным переносом ионов Н+. Таким образом, ЭТЦ митохондрий (как и тилакоидов) выполняет функцию окислительно-восстановительной Н+-помпы.
Особенностью растительных митохондрий от митохондрий животных является способность окислять экзогенный НАДН, т. е. НАДН, который поступает из цитоплазмы (рис. 3.7).
Это окисление происходит, по меньшей мере, двумя флавинами НАДН-дегидрогеназами, одна из которых локализована на внешней стороне внутренней мембраны митохондрий, а другая – на внутренней стороне. Первая из них передает электроны в ЭТЦ митохондрий на убихинон УХ, а вторая на цитохром с.
 |
Для функционирования НАДН-дегидрогеназы на внутренней стороне внутренней мембраны необходимо присутствие кальция.
Дата добавления: 2016-07-11; просмотров: 2205;











