Изотерма адсорбции. Уравнение Фрейндлиха.
Величина адсорбции (абсолютная А или избыточная Г) в каждом конкретном случае определяется температурой Т и давлением р (при газообразном адсорбтиве) или температурой Т и концентрацией С (при адсорбции из растворов). Как правило, в теории адсорбции при рассмотрении адсорбционного равновесия один из этих параметров поддерживается постоянным. Так, уравнение вида А = f (р)Т или Г = f (c)Т, связывающее величину адсорбции с давлением или концентрацией при постоянной температуре, называется изотермой адсорбции. Адсорбция (если она выражена не как избыток, а как полное содержание) всегда возрастает с повышением равновесного давления или концентрации. Так как адсорбция - процесс экзотермический, то при повышении температуры величина адсорбции снижается. На рис. 26.9 приведены основные виды кривых адсорбционного равновесия. Изотермам адсорбции при трех температурах (Т1 > Т2 >Т3) соответствует рис. 26.9а.
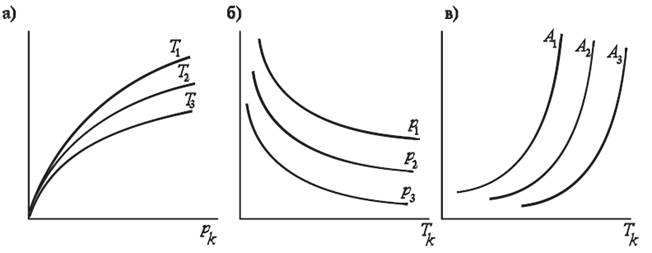
Рис 26.9. Кривые адсорбционного равновесия : изотермы (а), изобары (б) и изостеры (в) адсорбции
Уравнение, связывающее величину адсорбции с температурой при постоянном равновесном давлении А = f(T)p или постоянной равновесной концентрации Г = f (Т)с, носит название, соответственно, изобары или изопикны адсорбции (рис. 26.9 -б) ; здесь р1 > р2 > р3. Уравнение вида р = f (Т)А , изостера адсорбции (рис. 26.9 -в), связывает равновесное давление с температурой при постоянном адсорбированном количестве; в этом случае А1 >А2 >А3.
Задача любой адсорбционной теории - на базе определенной модели процесса адсорбции составить ее математическое описание. В идеале уравнение должно описывать зависимость равновесной величины адсорбции от концентрации адсорбата в объемной фазе при различных температурах, а также прогнозировать изменение теплоты адсорбции от заполнения адсорбента. Наиболее часто при этом находят уравнение изотермы адсорбции. Форма изотермы адсорбции на твердых телах зависит от многих параметров: свойств адсорбента и адсорбата, взаимодействия адсорбент адсорбат, взаимодействия молекул адсорбата между собой в газовой фазе и в адсорбированном состоянии. В области малыхдавлений (или концентраций) и соответствующих им малых заполнений поверхности взаимодействие между молекулами адсорбата незначительно и зависимость А = f(p)T сводится к простейшей форме, называемой законом Генри :
А = kp или А = k'c (26.20)
где k и к' - адсорбционный коэффициент (или коэффициент Генри), с - концентрация адсорбента в объемной фазе, р - давление пара адсорбата. Коэффициент Генри k является мерой интенсивности адсорбции. Можно показать, что любая теоретическая изотерма должна в пределе (при малых заполнениях) переходить в уравнение Генри.
В области средних концентраций зависимость адсорбции растворенных веществ от концентрации хорошо описывается эмпирическим уравнением Фрейндлиха:
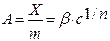 (26.21)
(26.21)
где Х - количество адсорбированного вещества, m - масса адсорбента, βи п - константы, характерные для каждой адсорбционной системы, причем 0 < 1/n < 1 . По Фрейндллиху, n не зависит от заполнения, хотя это утверждение не вполне точно. Этим эмпирическим уравнением часто пользуются для ориентировочных расчетов адсорбции. Чаще всего оно применяется в логарифмической форме:
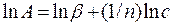 (26.22)
(26.22)
позволяющей построить линейную зависимость ln А - ln c и графически определить оба постоянных параметра β и n.
Дата добавления: 2020-07-18; просмотров: 570;











