Зависимость скорости химических реакций от концентрации реагентов. Кинетические уравнения
Законы химической кинетики основаны на двух постулатах, впервые установленных при изучении реакций в растворах:
1)скорость химической реакции пропорциональна концентрациям реагентов;
2)суммарная скорость нескольких последовательных превращений, различающихся по скорости, определяется скоростью наиболее медленной стадии.
В настоящее время в кинетике реакции делятся на простые, формально простые и сложные. Простыми называются реакции, осуществление которых связано с преодолением одного энергетического барьера при переходе из одного состояния реакционной системы в другое.
Кинетическое уравнение необратимой элементарной реакции
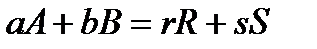
в соответствии с первым постулатом, основанном на законе действующих масс, имеет вид
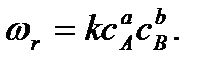
Коэффициент пропорциональности к, входящий в кинетическое уравнение, называется константой скорости. Константа скорости не зависит от концентрации реагирующих веществ. Величина константы скорости зависит от природы реагирующих веществ, температуры и присутствия катализатора. Числовое значение константы скорости равно количеству вещества, прореагировавшего за единицу времени при концентрации исходных веществ, равных единице. Наиболее распространенными типами сложных реакций являются параллельные и последовательные реакции. Если протекает многостадийная реакция, то скорость реакции по одному из участников определяется, как алгебраическая сумма скоростей тех стадий, в которых этот реагент принимает участие. Если реагент расходуется (является реагентом), то записывается в общей сумме со знаком «+». Те стадии, в которых он образуется (является продуктом), записываются со знаком «−».
Скорость химического превращения зависит от большого числа переменных. На скорость влияют не только факторы, определяющие состояние химического процесса (Т, р, состав реакционной смеси), но и наличие или отсутствие посторонних веществ, не претерпевающих изменений в результате реакций, условия физической транспортировки реагентов к реакционным центрам и др.
Факторы, оказывающие влияние на скорость химического превращения, подразделяют на две группы:
кинетические – определяющие скорость взаимодействия на молекулярном уровне;
макрокинетические – определяющие влияние на скорость реакции условий транспортировки реагентов к зонам реакции, наличия или отсутствия перемешивания, геометрических размеров реактора.
Влияние концентрации реагентов. Из кинетических уравнений следует, прежде всего, что скорость простой реакции пропорциональна концентрациям веществ, являющихся реагентами в данной реакции. Следовательно, для простых реакций увеличение концентраций исходных веществ практически всегда приводит к увеличению скорости (за исключением реакций нулевого порядка, скорость которых не зависит от концентрации).
Если реакция характеризуется различающимися частными порядками по компонентами А и В, то наибольшее влияние на скорость реакции будет оказывать изменение концентрации реагента, имеющего больший частный порядок.
Для сложных реакций вопрос о выборе концентраций реагентов для управления процессом не является однозначным. Рассмотрим для примера систему из двух параллельных реакций разного порядка при постоянной температуре.
Если порядок целевой реакции по исходному реагенту больше порядка побочной реакции, то скорость целевой реакции с ростом концентрации целевого реагента возрастает значительно быстрее скорости побочной реакции и доля скорости целевой реакции в суммарной скорости увеличится.
Когда порядок целевой реакции по исходному реагенту меньше порядка побочной реакции, более высокая селективность достигается при низкой концентрации исходного реагента.
Влияние температуры на скорость реакций. Энергия активации. Влияние температуры на скорость реакции выявил Вант-Гофф экспериментально. Было обнаружено, что при увеличении температуры на 10 градусов скорость реакции возрастает в 2-4 раза.
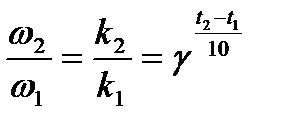
γ – температурный коэффициент реакции, показывает, во сколько раз увеличится скорость реакции при повышении температуры на 10 градусов.
Более точно влияние температуры на константу скорости установил Аррениус:
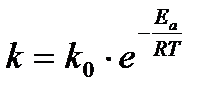
где к – константа скорости реакции; к0 – предэкспоненциальный множитель; Е – энергия активации реакции; R – универсальная газовая постоянная; Т – температура.
Энергия активации элементарной реакции Е – энергетический барьер, который должны преодолеть молекулы при переходе из одного состояния реакционной системы в другое.
Предэкспоненциальный множитель к0 учитывает число соударений, вероятность распада активированного комплекса реакции на исходные реагенты без образования продуктов реакции, пространственную ориентацию молекул реагентов, а также ряд других факторов, влияющих на скорость реакции и не зависящих от температуры.
Графически уравнение Аррениуса представляют в виде линейной зависимости логарифма константы скорости от обратной температуры: ln k = f (1/T).
Чем выше энергия активации реакции, тем более чувствительна она к изменениям температуры. Если энергия активации целевой реакции превышает энергию активации побочной реакции, то с ростом температуры наблюдается более быстрое увеличение скорости целевой реакции по сравнению с увеличением скорости побочной реакции и суммарной скорости процесса. В противном случае, для увеличения селективности нужно понижать, а не повышать температуру.
Дата добавления: 2016-07-05; просмотров: 3057;











