Константа равновесия и энергия Гиббса.
Для рассматриваемой реакции изменение энергии Гиббса выразится уравнением
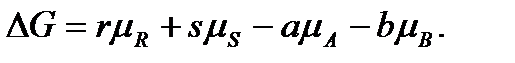
Поскольку все участники – идеальные газы, то при постоянной температуре
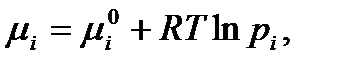
где μ0 – стандартный химический потенциал.
Получим следующее выражение:
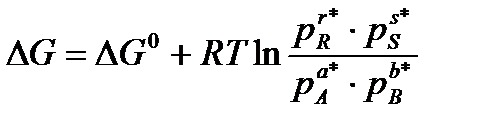
В условиях химического равновесия ΔG=0. Стандартная энергия Гиббса является характерной для реакции постоянной величиной. Поэтому и выражение под знаком логарифма должно быть постоянным. Обозначим его через Кр, которая является термодинамической константой равновесия.
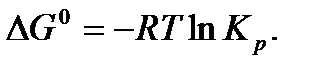
Указанное соотношение называют уравнением изотермы Вант-Гоффа. Порядок и знак величины ΔG0 позволяют качественно предвидеть положение равновесия реакции:
1)при ΔG0=0, КР=1, т.е. система находится в состоянии равновесия;
2)при ΔG0<0, КР»1, а это значит, что продукты реакции преобладают над исходными веществами (т.е. возможно самопроизвольное протекание прямой реакции при стандартных условиях);
3)при ΔG0>0, КР«1, следовательно, исходные вещества преобладают над продуктами реакции (другими словами, самопроизвольного протекания прямой реакции при стандартных условиях не наблюдается, предпочтительна обратная реакция).
Дата добавления: 2016-07-05; просмотров: 2594;











