Термодинамические характеристики химических реакций
При проектировании ХТП важное место занимают термодинамические расчеты химических реакций. Они позволяют сделать заключение о принципиальной возможности данного химического превращения, предварительно выбрать условия проведения процесса, определить равновесный состав продуктов, рассчитав теоретически достижимые степени превращения исходных веществ и выходы продуктов, а также энергетические эффекты (теплота реакции, теплота изменения агрегатного состояния и т.д.), что необходимо для составления энергетических балансов и определения энергетических затрат.
В начале превращения система находится в некотором заданном исходном состоянии, а после превращения переходит в новое для нее конечное состояние. Химическое превращение вещества называется реакцией:
С(ТВ) + 2СL2(Г) ← СCl4(Ж)
физическое превращение – процессом:
СCl4 (Г) ← СCl4(Ж)
Все эти изменения сопровождаются энергетическими изменениями, в частности выделением или поглощением теплоты. Термодинамическая система находится в состоянии равновесия, если ее состав и свойства не претерпевают видимых изменений при постоянных внешних условиях в течение неограниченного времени (при этом возможны небольшие колебания около точки равновесия, протекание прямой и обратной реакций).
Рассмотрим термодинамические характеристики.
Энтальпия реакции.
Протекание химической реакции сопровождается изменением энергии системы. Абсолютное значение энергии не может быть определено, так как нельзя привести систему в состояние, лишенное энергии. Но изменение энергии в результате протекания процесса можно определить, начиная отсчет от любого состояния системы, условно присвоив ему значение энергии, равное нулю.
В общем случае энергия системы складывается из кинетической энергии движения системы в целом, потенциальной энергии, обусловленной положением системы в каком-то внешнем поле, и внутренней энергии U.
В химической термодинамике рассматривают неподвижные системы в отсутствие внешнего поля – тогда полная энергия системы равна внутренней. Теплота Q, сообщенная системе, идет на изменение внутренней энергии U:
ΔU = U2 – U1,
где ΔU – изменение внутренней энергии, кДж; U2 – внутренняя энергия конечной системы, кДж; U1 – внутренняя энергии исходной системы, кДж.
Теплота также идет на преодоление сопротивлений, препятствующих изменению состояния системы, т.е. на совершение работы А. Следовательно,
Q = ΔU + A.
Если на система действует только постоянное внешнее давление, то для бесконечно малого изменения состояния уравнение примет вид:
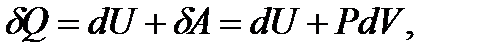
где δQ – бесконечно малое количество теплоты; dU – полный дифференциал внутренней энергии системы; δА – бесконечно малое количество работы.
Химические превращения чаще протекают при постоянном объеме. Перепишем уравнение следующим образом:
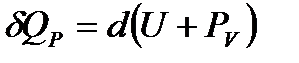
После интегрирования от U1 до U2 и от V1 до V2 имеем
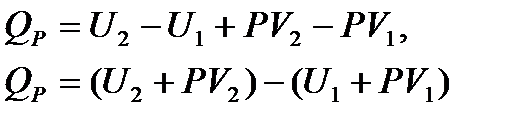
где U + PV – энтальпия реакции.
Следовательно,
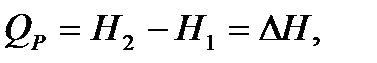
где ΔН – изменение энтальпии реакции или теплота химической реакции при постоянном давлении, кДж/моль.
Закон Гесса: изменение энтальпии реакции относится к системе и определяется ее начальным и конечным состояниями.
Из закона Гесса вытекают следующие положения:
1) Теплота образования соединения из исходных веществ не зависит от способа получения этого соединения;
2) Теплота разложения соединения до определенных исходных веществ равна и противоположна по знаку теплоте образования соединения из этих веществ;
3) Если из двух разных систем в результате различных процессов образуются одинаковые продукты, то разность между теплотами этих процессов равна теплоте перехода первой системы во вторую.
При проведении термодинамических расчетов необходимо все исходные данные относить к одинаковым «стандартным» условиям, в которых все продукты находятся в термодинамически устойчивом состоянии, а именно: при давлении 0,1 МПа и температуре 298 К (250С).
Энтальпия химической реакции можно определить по теплотам образования участвующих в ней простых веществ:
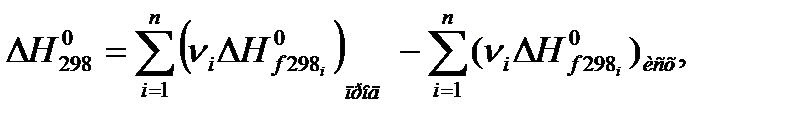
где ΔН0298 – тепловой эффект реакции, кДж/моль; ΔН0f298 – стандартная энтальпия образования вещества, кДж/моль.
Энтропия реакции.
Энтропия характеризует направление процесса. Энтропия – однозначная, непрерывная и конечная функция состояния системы. Следовательно, изменение ее не зависит от пути агрегатного перехода и определяется только начальным и конечным состояниями системы:
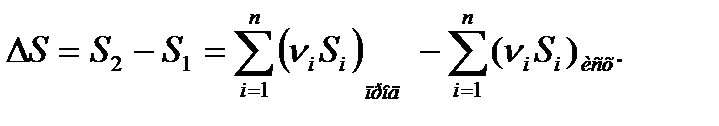
По знаку изменения энтропии процессы делятся на положительные (самопроизвольные) и отрицательные (несамопроизвольные). Таким образом, зная знак ΔS, можно говорить о направлении процесса. Самопроизвольные процессы происходят без затраты энергии извне, например расширение газа, смешивание газа, уменьшение давления.
Энергия Гиббса.
Энергия Гиббса – однозначная, непрерывная и конечная функция состояния системы, изменение которой не зависит от пути перехода и определяется начальным и конечным состояниями:
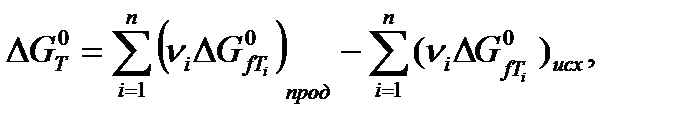
где 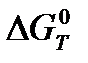 – изменение энергии Гиббса, кДж/моль;
– изменение энергии Гиббса, кДж/моль; 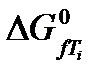 – энергия Гиббса образования веществ, кДж/моль; Т – температура, К.
– энергия Гиббса образования веществ, кДж/моль; Т – температура, К.
Дата добавления: 2016-07-05; просмотров: 8412;











