Гипофизотропные гормоны
Известные в настоящее время гипофизотропные гормоны гипоталамуса делятся на гормоны, усиливающие (высвобождающие, рилизинг-гормоны) и угнетающие (ингибирующие) секрецию и высвобождение (выделение) соответствующих тропных гормонов передней доли гипофиза. Комиссия по биохимической номенклатуре Международного общества чистой и прикладной химии Международного биохимического общества (1974 г.) рекомендовала принять окончание “либерин” в названиях гормонов гипоталамуса, усиливающих высвобождение соответствующих тропных гормонов гипофиза (например, кортиколиберин), и окончание “статин” в названиях гормонов с ингибирующим эффектом (например, соматостатин).
Установлено существование следующих гипофизотропных гормонов: 1) гормон, высвобождающий лютеинизирующий и фолликулостимулирующий гормоны – гонадолиберин (люлиберин); 2) кортикотропин-рилизинг-гормон кортиколиберин; 3) соматотропин-рилизинг-гормон – соматолиберин; 4) гормон, угнетающий высвобождение гормона роста – соматостатин; 5) пролактин-рилизинг-гормон – пролактолиберин, функцию которого выполняют, вероятно, тиролиберин и ВИП; 6) гормон, угнетающий высвобождение пролактина – пролактостатин, роль которого выполняет дофамин; 7) тиротропин-рилизинг-гормон – тиролиберин; 8) гормон, высвобождающий меланоцитостимулирующий гормон – меланолиберин; 9) гормон, угнетающий высвобождение меланоцитостимулирующего гормона – меланостатин. Существование двух последних гормонов у человека окончательно не доказано.
Гипофизотропные гормоны секретируются нейронами, локализованными в различных областях гипоталамуса. Так, паравентрикулярное ядро гипоталамуса содержит большое количество нейронов, секретирующих тиролиберин и кортиколиберин; дугообразное (аркуатное) ядро содержит нейроны, секретирующие соматолиберин и пролактостатин (дофамин); нейроны, секретирующие соматостатин, располагаются в передней гипоталамической области, а гонадолиберин – в предоптической области. Аксоны перечисленных нейронов заканчиваются в области срединного возвышения гипоталамуса, где начинается портальная система гипофиза, c помощью которой гипоталамус сообщается с передней долей гипофиза. Перечисленные химические медиаторы (гипофизотропные гормоны, моноамины), относящиеся к малым пептидам и биогенным аминам, высвобождаются из гипоталамических нейронов в систему портального кровообращения и, достигая клеток аденогипофиза, модулируют их специфическую активность. Установлено, что нервные терминали (аксоны) нейронов гипоталамуса имеют здесь тесные контакты с первичным капиллярным сплетением, где и происходит высвобождение гипофизотропных гормонов в кровь и их транспорт портальной системой к гипофизу. Концентрация гипофизотропных гормонов в этой системе наивысшая по сравнению с их содержанием в общем кровотоке.
Кортиколиберин.Кортитропин-рилизинг-фактор был первым из гипофизотропных гормонов, который был частично охарактеризован еще в 1955 г., однако лишь в 1983 г. W. Vale с сотрудниками представили полную химическую и клиническую его характеристику. Интересно, что для получения 1 мг этого гормона (такое количество необходимо для химической характеристики) исследователи фракционировали 500 тысяч гипоталамусов овцы. В последующие годы кортиколиберин был выделен и из гипоталамуса свиньи, крысы, человека и других животных. Этот пептид состоит из 41 аминокислотного остатка. Основное количество кортиколиберина локализуется в гипоталамусе, однако он выявляется и в других отделах ЦНС, включая кору головного мозга и различные ядра. Многочисленными исследованиями показано, что адреналэктомия или гипофизэктомия приводит к увеличению содержания кортиколиберина в указанных областях гипоталамуса. Изучение структуры кортиколиберина, полученного из гипоталамуса различных животных, показало, что только кортиколиберин человека и крысы имеет идентичную структуру.
Период полураспада кортиколиберина в плазме составляет около 60 минут. Кортиколиберин селективно увеличивает высвобождение АКТГ.
Соматолиберин. Соматотропинвысвобождающий фактор был выделен из гипоталамуса еще в 1964 г. Однако его химическая структура была установлена лишь в 1980-е годы, когда вначале L. Frohman и соавт. (1981) частично охарактеризовали пептид, обладающий способностью усиливать высвобождение СТГ. Химическая структура соматолиберина была установлена R. Guillemin и соавт. (1981). Молекула соматолиберина включает 44 аминокислотных остатка, причем биологическую активность проявляет ее часть с первыми 29 аминокислотными остатками.
Однократное введение соматолиберина приводит к более чем 20-кратному повышению содержания СТГ в крови, которое снижается до исходного уровня в течение 3 ч. Имеются сообщения, что при этом может незначительно изменяться уровень пролактина в крови. Период полураспада соматолиберина в крови составляет около 7 мин.
Исследования показали, что соматолиберин синтезируется в дугообразном (аркуатном) и вентромедиальном ядрах гипоталамуса.
Соматостатин. При попытках выделить из гипоталамуса овец соматолиберин в лаборатории, руководимой Р. Гелемином, в 1973 г. был получен полипептид, который угнетал высвобождение гормона роста из культуры гипофиза крыс (P. Brazeau и соавт., 1973). В том же году была расшифрована структура. Таким образом, соматостатин является тетрадекапептидом.
L. Pradayrol и соавт. (1980) первыми показали, что в тканях соматостатин присутствует в нескольких формах и, в частности, в форме белка, химическая структура которого включает 28 аминокислотных остатков.
В настоящее время доказаны следующие влияния соматостатина: 1) ингибирование секреции гастрина, секретина, ТТГ, СТГ, инсулина, глюкагона, мотилина, глицентина, ВИП, ренина; 2) угнетение секреции соляной кислоты и пепсина желудком, уменьшение моторики желудка, ингибирование секреции бикарбонатов и ферментов поджелудочной железой, снижение абсорбции в кишечнике, уменьшение кровотока на всем протяжении желудочно-кишечного тракта, снижение секреции и транспорта желчи.
Сниженное количество соматостатина в гипоталамусе гипофизэктомированных крыс восстанавливалось до нормы под влиянием экзогенного СТГ.
Тиролиберин.Установлено, что высвобождение ТТГ из передней доли гипофиза регулируется гипоталамусом посредством тиротропин-рилизинг-гормона, или тиролиберина. Химическая структура тиролиберина была установленна 1970 году, первым из гипофизотропных гормонов.
Вскоре после установления структуры тиролиберина он был синтезирован, причем биологическая активность натурального и синтетического препарата оказалась идентичной.
Цитоиммунохимические исследования показали, что тиролиберин широко представлен в ЦНС и желудочно-кишечном тракте. Опыт клиничекого применения тиролиберина показал, что его введение уже в течение первых 5 минут стимулирует высвобождение ТТГ в кровь и последующее повышение уровня тироидных гормонов. Кроме специфического влияния на ТТГ, тиролиберин увеличивает уровень пролактина в сыворотке крови, проявляя свойства пролактолиберина. Тиролиберин влияет на поведенческие реакции, усиливает двигательную активность, проявляет депрессивные эффекты.
Гонадолиберин.Известно, что репродуктивная функция организма регулируется гипофизом (посредством ФСГ, ЛГ и пролактина), а функция последнего находится под контролем ЦНС, в том числе гипоталамуса. Разрушение гипоталамуса при интактном гипофизе и полной сохранности его кровоснабжения приводит к атрофии гонад и полностью прекращает половое развитие животных.
Ранее считалось, что в гипоталамусе секретируется люлиберин, высвобождающий ЛГ, и фоллиберин, высвобождающий ФСГ.
В настоящее время ни у кого не вызывает сомнения, что гипоталамическая регуляция ФСГ и ЛГ осуществляется одним гормоном – гонадолиберином. Нейроны, содержащие гонадолиберин, выявляются в обширной области гипоталамуса от перекреста зрительных нервов до супраоптического ядра, но наибольшее их количество локализуется в медиобазальном гипоталамусе. Гонадолиберин секретируется пульсирующим образом (всплески активности продолжаются в течение 8-16 мин и повторяются в интервалах через 37-56 мин). При введении гонадолиберина отмечается его быстрое накопление в печени, почках и гипофизе. Синтезирован гонадолиберин для клинического применения. Он индуцирует половое созревание, либидо, потенцию, овуляцию или сперматогенез. Гонадолиберин оказывает выраженное влияние на половое поведение животных, воздействуя на сексуальные центры ЦНС. Период полураспада гонадолиберина в плазме составляет 5-7 минут. Пролактолиберин. Из экстрактов гипоталамуса различных животных (крысы, птицы и др.) изолированы фракции, обладающие способностью высвобождать пролактин. из гранул. Обнаружен также в срединном возвышении и экстрагипо-таламических структурах. Химическая природа не установлена и вопрос о его применении окончательно не решен.
Пролактостатин. Известно, что ЦНС млекопитающих участвует в регуляции секреции пролактина, которая подвержена различным влияниям (акт сосания, эмоциональный стресс и др.). В противоположность действию на другие гормоны передней доли гипофиза в отношении секреции пролактина гипоталамус оказывает тоническое тормозящее влияние. Перерезка ножки гипофиза, т.е. перерыв связи между гипоталамусом и аденогипофизом, приводит к повышению высвобождения пролактина.
В 1974-1977 гг. в лаборатории, руководимой А. Шелли, из гипоталамуса свиньи были получены высокоочищенные фракции пролактостатина.
В настоящее время считают, что роль пролактостатина в организме выполняет дофамин. Это подтверждает и клиническая практика, показавшая успешное применение для лечения гиперпролактинемии агонистов дофамина (парлодел, лизурид и др.).
Меланолиберин и меланостатин. На протяжении многих лет проводятся исследования по выяснению механизмов гипоталамической регуляции секреции меланоцитостимулирующего гормона. В лаборатории, руководимой A. Schally (1966-1974), путем ферментативного разрушения окситоцина было получено несколько пептидов, из которых пептид Pro-Leu-Gly-NH2 обладал наибольшей меланостатической активностью (меланостатин-1). Из гипоталамуса крупного рогатого скота был выделен другой пептид, который угнетал высвобождение МСГ из гипофиза. Помимо меланостатина, из гипоталамуса животных был получен гормон, усиливающий высвобождение МСГ-меланолиберин (пентапептид). Незначительные количества этого гормона снижали содержание МСГ в гипофизе и повышали его уровень в крови экспериментальных животных (крыс).
Кроме того, в переднем отделе гипоталамуса располагаются парные супраоптические и паравентрикулярные ядра, образованные крупными холинергическими нейросекреторными клетками. В нейронах этих ядер продуцируются белковые нейрогормоны - вазопрессин, или антидиуретический гормон, и окситоцин. У человека выработка антидиуретического гормона совершается преимущественно в супраоптическом ядре, тогда как продукция окситоцина преобладает в паравентрикулярных ядрах. Вазопрессин и окситоцин по разветвлениям аксонов нейро-секреторных клеток поступают в заднюю долю гипофиза, и накапливаются в расширении аксонов, которое лежит выше аксовазального синапса и называется накопительным тельцем Геринга., откуда разносятся кровью.
Таким образом, гипоталамус является высшим центром регуляции эндокринных функций, он объединяет нервные и эндокринные регуляторные механизмы в общую нейро-эндокринную систему, координирует нервные и гормональные механизмы регуляции функций внутренних органов.
Гипофиз
Гипофиз (от греческого "гипо" - под; нижний придаток мозга) - это небольшая, овальной формы железа находится на основании головного мозга (нижней поверхности) в гипофизарной ямке турецкого седла клиновидной кости, отделяется от полости черепа отростком твердой оболочки головного мозга и образует диафрагму седла. Диафрагма седла имеет в центре отверстие, через которое гипофиз соединён с воронкой гипоталамуса промежуточного мозга; посредством её гипофиз связан с серым бугром, расположенным на нижней стенке III желудочка. По бокам гипофиз окружён пещеристыми синусами. Снаружи гипофиз накрыт капсулой. Масса гипофиза колеблется в зависимости от возраста и состояния организма. У новорожденного в возрасте до 2 мес. она составляет 0,07-0,1 г. Затем масса гипофиза увеличивается, особенно в пубертатный период и к 14-19 годам достигает максимума (у девушек-0,7 г, у юношей-0,66 г). Масса гипофиза у взрослого человека составляет 0,6-0,7 г. При беременности масса гипофиза увеличивается до 1 г, что связано с повышением его функциональной активности в этот период. В некоторых случаях у многорожавших женщин масса гипофиза достигает 1,6 г. После родов масса гипофиза уменьшается, но не до исходных цифр, поэтому у женщин она может быть значительно больше, чем у мужчин того же возраста. Поперечный размер гипофиза 10-17 мм, переднезадний - 5-15 мм, вертикальный - 5-10 мм. Гипофиз развивается из двух эктодермальных зачатков различного происхождения: выпячивания первичного ротового углубления (карман Ратке) и выпячивания дна 3-го желудочка мозга (воронка). В дальнейшем из передней стенки кармана Ратке образуется передняя доля гипофиза, из задней – промежуточная его доля. Задняя доля и ножка гипофиза образуются из вертикального выпячивания дна 3-го желудочка мозга. Гипофиз в виде самостоятельного образования выявляется уже на 4-5-й неделе беременности, а дифференцировка клеточного состава заканчивается к 20-й неделе эмбриональной жизни.
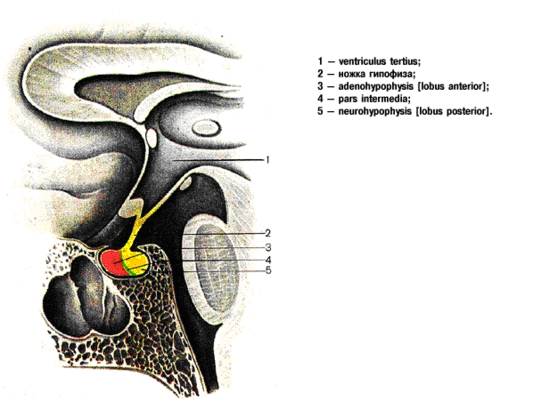
Рис. 6. Гипофиз (схема).
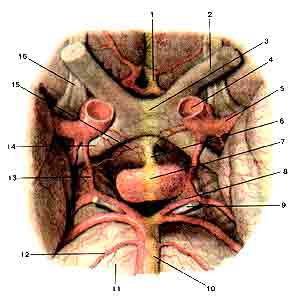
Рис. 7. Гипофиз (hipophysis) Вид снизу:
7-гипофиз
В гипофизе выделяют переднюю (аденогипофиз) и заднюю (нейрогипофиз) доли. У многих животных представлена также промежуточная доля (pars intermedia), однако у человека она практически отсутствует.
Аденогипофиз, или железистая доля гипофиза, составляет около 75% от массы всего гипофиза. Он состоит из тяжей и скоплений эпителиальных железистых клеток, которые разделяются многочисленными тяжами-трабекулами. Строма передней доли гипофиза представлена соединительной тканью. Гистологически в передней доле гипофиза
различали 3 группы клеток: ацидофилы, базофилы и хромофобные клетки.
Современные методы исследования – иммуноцитохимия и электронная микроскопия – позволили пересмотреть классификацию клеток передней доли гипофиза, положив в ее основу их функциональные особенности. В соответствии с этим в аденогипофизе различают 5 типов клеток: соматотрофы, лактотрофы, кортикотрофы, тиротрофы, гонадотрофы. Первые 2 вида клеток ранее относили к ацидофильным клеткам, а остальные клетки относились к базофилам.Соматотрофы, или клетки, продуцирующие гормон роста (соматотропный гормон, СТГ), составляют почти 50% всего клеточного состава аденогипофиза. Локализуются преимущественно в латеральных отделах гипофиза.
Лактотрофы, или клетки, продуцирующие пролактин, составляют 15-20% клеточного состава гипофиза, располагаются в заднелатеральной области гипофиза. Лактотрофы в гипофизе эмбриона появляются последними, и их количество к концу беременности значительно увеличивается под влиянием эстрогенов матери. После родов их количество уменьшается и остается низким в течение всего детства. Количество лактотрофов увеличивается почти в 2 раза при беременности и увеличение массы и размеров гипофиза, наблюдаемое при каждой беременности, обусловлено резкой истинной гиперплазией лактотрофов.
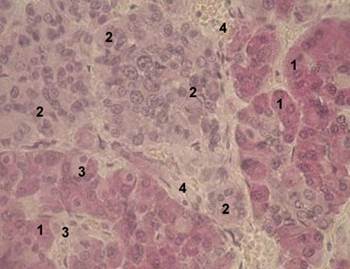
Рис. 8. Передняя доля гипофиза человека:
1 - ацидофильные клетки; 2 - базофильные клетки; 3 - хромофобные клетки;
4 - прослойки соединительной ткани.
Тиротрофы, или клетки, секретирующие тиреотропный гормон (ТТГ), составляют около 5% клеточного состава аденогипофиза. Тиротрофы локализуются в переднемедиальной и переднелатеральной областях гипофиза. При первичном гипотирозе они гиперплазируются, увеличивается их количество, что приводит к образованию аденомы. И, наоборот, при тиротоксикозе уменьшается количество и размер тиротрофов. Кортикотрофы, или клетки, секретирующие адренокортикотропный гормон (АКТГ), локализуются в переднемедиальной части гипофиза и составляют около 15-20% от всех клеток аденогипофиза. При длительном гипокортицизме наблюдается увеличение количества кортикотрофов и их вакуолизация.
Гонадотрофы, или клетки, секретирующие гонадотропины (фолликулостимулирующий гормон, ФСГ и лютеинизирующий гормон ЛГ), составляют около 10-15% от клеточного состава аденогипофиза. Они локазизуются повсеместно по передней доле гипофиза, но преимущественное их количество выявляется в латеральных отделах гипофиза. После удаления половых желез в гипофизе выявляются “кастрационные” клетки, или клетки гонадэктомии, представляющие собой большие гонадотрофы с бледной вакуолизованной протоплазмой и ядром, расположенным на периферии. При первичном гипогонадизме выявляется гипертрофия гонадотрофов, иногда приводящая к увеличению размеров гипофиза.
Применение иммунохимических методов идентификации клеток передней доли гипофиза показало, что часть клеток передней доли гипофиза не секретируют каких-либо гормонов. Такие клетки раньше назывались хромофобными клетками, а в соответствии с настоящей классификацией – нулевыми клетками.
Промежуточная, доля гипофиза, как и передняя, — эпителиального происхождения. У человека ее функцию выполняет небольшая группа клеток передней части задней доли, эмбриологически и функционально связанных с аденогипофизом.
Эндокриноциты промежуточной доли способны вырабатывать меланоцитостимулирующий гормон (МСГ), а также липотропный гормон (ЛПГ).
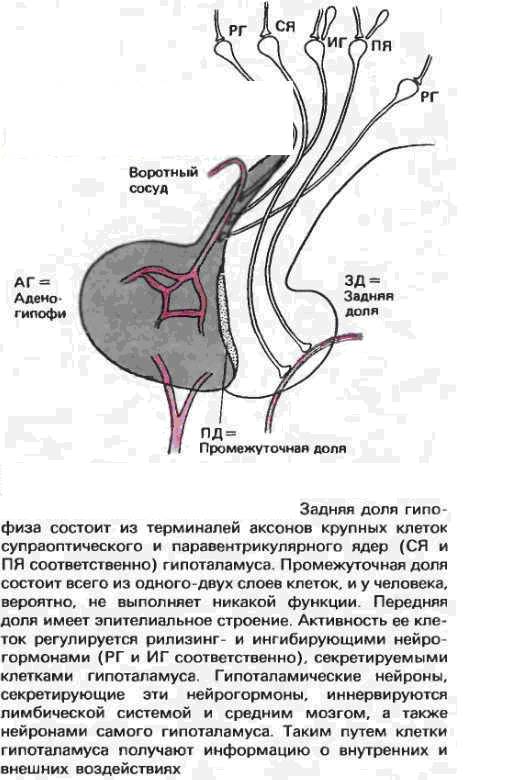
Рис. 9. Расположение передней (АГ), промежуточной (ПГ) и задней (ЗД) долей гипофиза по отношению к гипоталамусу и воротной системе.
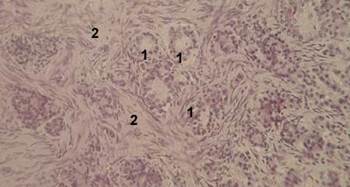
Рис. 10. Промежуточная доля гипофиза человека:
1 - фолликулоподобные структуры; 2 - прослойки соединительной ткани.
Задняядоля гипофиза (нейрогипо́физ), состоит из нервной доли и воронки, соединяющей нервную долю со срединным возвышением промежуточного мозга. Нервная доля образована клетками эпендимы (питуицитами) и окончаниями аксонов нейросекреторных клеток паравентрикулярного и супраоптического ядер гипоталамуса, в которых и синтезируются вазопрессин (антидиуретический гормон) и окситоцин, транспортируемые по нервным волокнам, составляющим гипоталамо-гипофизарный тракт, в нейрогипофиз.
В задней доле гипофиза эти гормоны депонируются и оттуда поступают в кровь. Нейрогипофиз – место не только депонирования, но и своеобразной активации поступающих сюда нейрогормонов, после чего они высвобождаются в кровь.
Синтез гормонов передней доли гипофиза происходит не одновременно.
На 9-й неделе беременности в гипофизе плода выявляются гормон роста и АКТГ. Почти в это же время иммуноцитохимическими методами подтверждается наличие ТТГ, ФСГ, ЛГ.
Пролактин выявляется на 19-20-й неделе беременности, гипоталамические гормоны (окситоцин и вазопрессин) выявляются в гипофизе и гипоталамусе уже на 10-11-й неделе беременности.
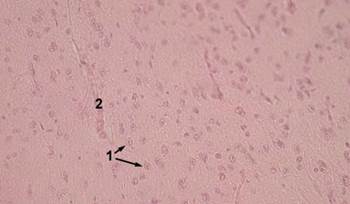
Рис. 11. Задняя доля гипофиза человека:
1 - ядра питуицитов; 2 - кровеносные сосуды.
Возрастные изменения в гипофизе. В постнатальном периоде активируются преимущественно ацидофильные клетки (очевидно, в связи с обеспечением повышенной продукции соматотропина, стимулирующего быстрый рост тела), а среди базофилов преобладают тиротропоциты.
В пубертатном периоде, когда наступает половое созревание, увеличивается количество базофильных гонадотропов.
Аденогипофиз обладает ограниченной регенераторной способностью, главным образом за счет специализации хромофобных клеток. Задняя доля гипофиза, образованная нейроглией, регенерирует лучше.
По важности выполняемых в организме функций гипофиз можно сравнить с ролью дирижёра оркестра, который лёгкими взмахами палочки показывает, когда тот или иной инструмент должен вступать в игру. Поэтому признаем вслед за знаменитым канадским патофизиологом Г. Селье, что гипофиз - своеобразный "эндокринный мозг". Гипофиз действительно дирижер, и как таковой обычно исполняет не свою музыку. Композитором же надо признать гипоталамус - отдел ствола мозга, для которого характерно скопление нейросекреторных клеток.
Гипофиз вырабатывает гормоны, которые стимулируют работу практически всех других желёз внутренней секреции.
Гормон роста.
На рост и развитие организма влияют многие гормоны, но наиболее важную роль в этом сложном процессе играет, видимо, именно гипофизарный гормон роста (соматотропин). Соматотропин секретируется аденогипофизарными клетками непрерывно и «вспышками» через 20—30 мин и 3—5 ч с отчетливой суточной ритмикой — повышение секреции соматотропина происходит во время глубокого сна, на ранних его стадиях (народная мудрость гласит: «человек растет, когда спит»). После удаления гипофиза рост практически прекращается. Введение этого гормона молодым животным ускоряет рост, а у взрослых может приводить к его возобновлению, причем исследование обмена веществ в этих случаях, всегда выявляет снижение экскреции (выведения) азота из организма. Задержка азота – необходимый признак истинного роста, свидетельствующий о том, что действительно происходит образование новых тканей, а не просто увеличение массы тела за счет накопления жира или воды. Стимуляция процессов роста обусловлена способностью соматотропина, усиливать образование белка в организме, повышать синтез РНК, усиливать транспорт аминокислот из крови в клетки. Органами-мишенями для него являются кости, а также образования, богатые соединительной тканью, — мышцы, связки, сухожилия, внутренние органы. Наиболее ярко влияние гормона выражено на костную и хрящевую ткани. Кроме того, усиливаются также процессы минерализации костной ткани, в результате чего в организме происходит задержка кальция и фосфора. Действие соматотропина происходит посредством "соматомединов", которые образуются в печени под влиянием соматотропина. Обнаружено, что у пигмеев на фоне нормального содержания соматотропина не образуется соматомедин С, что, по мнению исследователей, служит причиной их маленького роста. Соматотропин обладает выраженным действием на углеводный обмен. Под влиянием данного гормона увеличивается содержание глюкозы в плазме крови. Гормон усиливает мобилизацию жира из депо и использование его в энергетическом обмене.
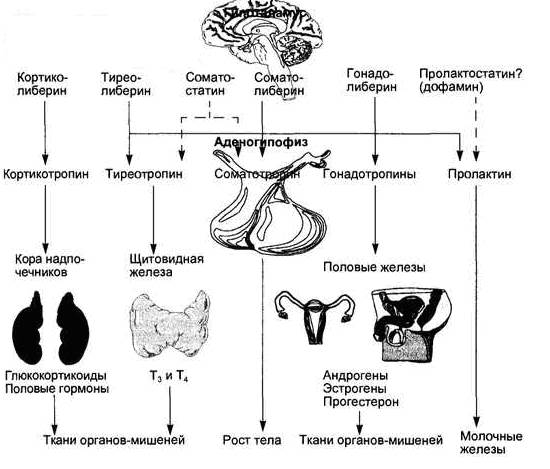
Рис. 12. Основные гормоны аденогипофиза, регуляция их секреции гипоталамическими нейропептидами и основные эффекты.
Сплошные стрелки — стимуляция, пунктирные стрелки — подавление секреции.
При патологических процессах нарушается секреторная функция гипофиза. Если гиперфункция передней доли гипофиза проявляется в детском возрасте, то это приводит к усиленному пропорциональному росту в длину - гигантизму. Если гиперфункция возникает у взрослого человека, когда рост тела в целом уже завершен, наблюдается увеличение, лишь тех частей тела, которые еще способны расти. Это пальцы рук и ног, кисти и стопы, нос и нижняя челюсть, язык, органы грудной и брюшной полостей. Это заболевание называется акромегалией. Причиной являются доброкачественные опухоли гипофиза. Гипофункция передней доли гипофиза в детстве выражается в задержке роста - карликовости ("гипофизарный нанизм"). Для этой болезни характерны отставание в росте (в возрасте 20 лет - менее 120 см у женщин и 130 см у мужчин), пропорциональное уменьшение всех частей тела и внутренних органов. Имеется половое недоразвитие. Умственное развитие не нарушено. Увеличивается секреция гормона после мышечных нагрузок, под влиянием травм, инфекций, голодания. Снижение содержания глюкозы и жирных кислот, избыток аминокислот в плазме крови также приводят к увеличению секреции соматотропина. Стимулируют продукцию соматотропина вазопрессин, глюкагон, эстрогены, дофамин, норадреналин, эндорфин и серотонин. Соматотропин обладает видовой специфичностью. Лактогенный гормон гипофиза (пролактин) стимулирует рост молочных желез и способствует образованию молока.
Гормон стимулирует синтез белка - лактальбумина, жиров и углеводов молока. Пролактин стимулирует также образование желтого тела и выработку им прогестерона. Влияет на водно-солевой обмен организма, задерживая воду и натрий в организме, усиливает эффекты альдостерона и вазопрессина, повышает образование жира из углеводов.
Он стимулирует рост внутренних органов, эритропоэз, способствует появлению инстинкта материнства. Пролактин присутствует в гипофизе особей не только женского, но и мужского пола, причем не только у млекопитающих, но и у низших позвоночных.
Относительно его функций в мужском организме и у животных, не относящихся к млекопитающим, известно мало. У некоторых птиц пролактин стимулирует развитие зобного мешка. Поскольку «зобное молоко», вырабатывающееся в этом мешке, служит для вскармливания птенцов, такоедействие гормона функционально сходно с его действием у млекопитающих. У рыб пролактин участвует в регуляции осмотического давления крови.
|
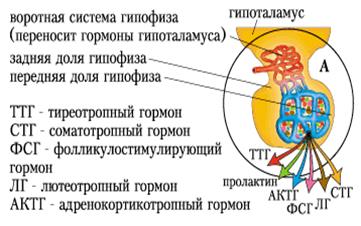
Рис. 13. Гипоталамус+гипофиз.
Стимуляцию секреции пролактина вызывают пептиды, выделяющиеся гипоталамусом: тиреолиберин, вазоактивный интестинальный полипептид (ВИП), ангиотензин II, вероятно, эндогенный опиоидный пептид В-эндорфин. Повышается секреция пролактина при беременности, кормлении грудью, во время сна, физической нагрузки, стресса. Эстрогены стимулируют синтез и секрецию пролактина. Угнетает продукцию пролактина дофамин гипоталамуса, который, вероятно, также тормозит клетки гипоталамуса, секретирующие гонадолиберин, что приводит к нарушению менструального цикла - лактогенной аменорее. Избыток пролактина наблюдается при доброкачественной аденоме гипофиза (гиперпролактинемическая аменорея), при менингитах, энцефалитах, травмах мозга, при применении некоторых противозачаточных средств. К его проявлениям относятся выделение молока у некормящих женщин (галакторея) и аменорея. Лекарственные вещества, блокирующие рецепторы дофамина (особенно часто психотропного действия), также приводят к повышению секреции пролактина, следствием чего могут быть галакторея и аменорея.
Тиреотропный гормон гипофиза (тиреотропин) стимулирует рост щитовидной железы и ее секреторную активность. Тиреотропин-гликопротеидный гормон аденогипофиза секретируется непрерывно, с ритмичными колебаниями в течение суток, при этом максимум содержания в крови приходится на вечерние часы. Увеличение секреции гормонов щитовидной железы происходит за счет усиления в тиреоцитах пластических процессов (синтез белка, нуклеиновых кислот) и увеличенного поглощения кислорода. Под влиянием тиреотропина активируется работа «йодного насоса», усиливаются процессы йодирования тирозина. Кроме того, увеличивается активность протеаз, расщепляющих тиреоглобулин, что способствует высвобождению активного тироксина и трийодтиронина в кровь. Увеличение массы щитовидной железы происходит благодаря увеличению синтеза пурина и пиримидина, РНК, белка и фосфолипидов тиреотропин. После удаления гипофиза функция щитовидной железы полностью прекращается, и она уменьшается в размерах. Введение тиреотропина может вызвать избыточную активность щитовидной железы. Таким образом, нарушения ее функции могут быть следствием не только заболеваний самой железы, но и патологических процессов в гипофизе и соответственно требуют разного лечения. Секреция тиреотропина стимулируется тиреолиберином гипоталамуса, а подавляется соматостатином. По механизму отрицательной обратной связи повышение содержания в крови гормонов щитовидной железы (трийодтиронина и тет-райодтиронина), ведет к подавлению секреции тиреотропина. Тормозят секрецию тиреотропина дофамин, глюкокортикоиды и соматотропин, а стимулируют — вазопрессин и антагонисты дофаминовых рецепторов. Тиреотропин секретируется в повышенных количествах при действии на организм низкой температуры, другие же воздействия — травма, боль, наркоз — секрецию гормона подавляют. Избыточная секреция тиреотропина приводит к развитию зоба, гиперфункции щитовидной железы с эффектами избытка тиреоидных гормонов (тиреотоксикоз), пучеглазию (экзофтальм). Внетиреоидное действие тиреотропина проявляется повышением образования гликозаминогликанов в коже и подкожной клетчатке, что ведет к так называемому слизистому отеку, или микседеме. Это происходит, например, при дефиците йода и недостаточной продукции гормонов щитовидной железы, когда по механизму обратной связи возрастает секреция тиреотропина.
Адренокортикотропный гормон (АКТГ), или кортикотропин, оказывает стимулирующее действие на кору надпочечников. Кортикотропин - является продуктом расщепления гликопротеина проопиомеланокортина.
В большей степени его влияние выражено на пучковую зону, что приводит к увеличению образования глюкокортикоидов, в меньшей - на клубочковую и сетчатую зоны, поэтому на продукцию минералокортикоидов и половых гормонов он не оказывает значительного воздействия.
АКТГ усиливает синтез холестерина и скорость образования прегненолона (предшественник всех стероидов надпочечников) из холестерина.
Под влиянием кортикотропина усиливается синтез белков ткани, что приводит к увеличению массы клеток пучковой зоны. Образование АКТГ регулируется кортиколиберином гипоталамуса. Продукция кортикотропина резко возрастает при действии на организм стрессорных раздражителей, например холода, боли, физической нагрузки, повышения температуры тела, эмоций, а также под влиянием гипогликемии (снижение сахара в крови), при этом суточная ритмика секреции исчезает. Торможение продукции АКТГ происходит под влиянием самих глюкокортикоидов по механизму обратной связи. Избыток АКТГ приводит к гиперкортицизму, т.е. увеличенной продукции кортикостероидов, преимущественно глюкокортикоидов. Это заболевание развивается при аденоме (опухоль) гипофиза и носит название болезни Иценко-Кушинга. Основные проявления ее: гипертония, ожирение, имеющее локальный характер (лицо и туловище), гипергликемия, снижение иммунной защиты организма.
Недостаток гормона ведет к уменьшению продукции глюкокортикоидов, что проявляется нарушением метаболизма и снижением устойчивости организма к различным влияниям среды. Вненадпочечниковые эффекты АКТГ заключаются в стимуляции липолиза (мобилизует жиры из жировых депо и способствует окислению жиров), увеличении секреции инсулина и соматотропина, накоплении гликогена в клетках мышечной ткани, гипогликемии, что связано с повышенной секрецией инсулина, усилении пигментации за счет действия на пигментные клетки меланофоры.
Гонадотропные гормоны (гонадотропины), фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ). По химической структуре ЛГ и ФСГ — гликопротеиды. ФСГ находится в крови в свободной форме, и период его полураспада составляет 55-60 мин, а ЛГ — 25-30 мин.
Фолликулостимулирующий гормон (ФСГ), или фоллитропин, вызывает рост и созревание фолликулов яичников, и их подготовку к овуляции. У мужчин под влиянием ФСГ происходит образование сперматозоидов.
Лютеинизирующий гормон (ЛГ), или лютропин, способствует разрыву оболочки созревшего фолликула, т.е. овуляции и образованию желтого тела. ЛГ стимулирует образование прогестерона в желтом теле и женских половых гормонов – эстрогенов в яичниках. Под влиянием ЛГ в яичниках увеличивается количество холестерина, необходимого для синтеза гормонов. У мужчин этот гормон способствует образованию мужских половых гормонов - андрогенов. Введение этих гормонов или их избыточная продукция вследствие заболевания вызывают преждевременное половое развитие незрелого организма. При удалении гипофиза или его разрушении патологическим процессом возникают изменения, сходные с теми, что происходят при кастрации. Регуляция секреции гонадотропинов осуществляется гипоталамическим гонадолиберином.
Существенное значение имеет также механизм отрицательной обратной связи — секреция обоих гормонов тормозится при повышенном содержании эстрогенов и прогестерона в крови; выработка ЛГ уменьшается при увеличении продукции тестостерона. Угнетающее действие на выделение ЛГ оказывают пролактин и глюкокортикоиды.
Регуляторами выработки ФСГ, согласно современным представлениям, помимо гипоталамических либеринов являются ингибин, активин и фоллистатин. Меланоцитостимулирующий гормон (МСГ, меланотропин, интермедин), у взрослого человека, в отличие от животных с обильным волосяным покровом, практически не синтезируется. Основная его функция заключается в стимуляции биосинтеза кожного пигмента меланина, а также в увеличении размеров и количества пигментных клеток. Функции этого гормона, заключающиеся, в конечном счете, в повышении пигментации кожи и волос, выполняют у человека кортикотропин и липотропин. При избыточной секреции кортикотропина усиливается пигментация кожи.
Меланотропин играет роль мозгового пептида в нейрохимических процессах памяти. Лишенные этого гормона головастики из-за сокращения (сжатия) пигментных клеток приобретают серебристый цвет.
МСГ образуется из той же молекулы-предшественника, что и адренокортикотропный гормон (АКТГ). В передней доле гипофиза этот предшественник превращается в АКТГ, а в промежуточной – в МСГ. При низком уровне глюкокортикоидов (болезнь Аддисона) отмечается усиленная пигментация кожи, что связано с повышенной активностью МСГ в плазме, хотя после рождения у людей МСГ не обнаружен.
Липотропный гормон (ЛПГ), усиливает метаболизм липидов и повышает пигментацию кожи и волос у человека.
Антидиуретический гормон (АДГ), или вазопрессин, при введении в организм вызывает многочисленные эффекты, в том числе повышение кровяного давления вследствие сужения сосудов и уменьшение диуреза (выведения мочи). Органами-мишенями вазопрессина являются почки и артерии. Из-за сосудосуживающего эффекта его также называют вазопрессином. Однако в нормальных условиях он оказывает в организме лишь одно известное действие – регулирует количество воды, выделяющееся через почки. Даже под влиянием чрезвычайно малых его концентраций вода, профильтровавшаяся в почечных клубочках, всасывается обратно в почечных канальцах (реабсорбируется), и образуется концентрированная моча. Антидиуретическое его действие заключается в стимуляции реабсорбции воды в дистальном отделе нефрона. Нейропептид вазопрессин участвует в формировании жажды и питьевого поведения, механизмах терморегуляции, в нейрохимических механизмах памяти, формировании биологических ритмов и эмоционального поведения.
При разрушении задней доли гипофиза опухолями или другими патологическими процессами развивается состояние, называемое несахарным диабетом. Наблюдается учащенное мочеиспускание (поллакиурия), в результате которого больной за сутки выделяет до 10—20 л мочи низкой относительной плотности. Симптомы этого заболевания проходят при введении синтетического вазопрессина или препаратов, приготовленных из задней доли гипофиза животных. Возникает сильная жажда, и чтобы избежать обезвоживания, больным приходится потреблять соответст
Дата добавления: 2018-11-26; просмотров: 2354;











