КОВАЛЕНТНАЯ СВЯЗЬ. ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ И ГЕОМЕТРИЧЕСКАЯ ФОРМА МОЛЕКУЛ
Ковалентная связь (КС) – тип связи, который возникает при обобществлении электронов взаимодействующих атомов. Для описания такого вида связи используют метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
МВС (иначе метод локализованных электронных пар) основан на следующих положениях:
1. КС образуется двумя атомами за счет перекрывания двух электронных облаков с антипараллельными спинами;
2. Связь располагается в том направлении, в котором будет обеспечиваться наибольшая область перекрывания электронов;
3. КС тем прочнее, чем больше область перекрывания атомных орбиталей (АО).
КС может возникнуть по обменному механизму за счет объединения одноэлектронных АО внешнего энергетического уровня по одному со стороны каждого атома. Число одноэлектронных АО может увеличиваться при переходе атома в возбужденное состояние. Кроме того, КС может образоваться по донорно-акцепторному механизму за счет объединения пары электронов одного атома (донора) и свободной АО другого атома (акцептора).
Основными свойствами КС являются насыщаемость, направленность и полярность. Общее число КС, которое способен образовать атом, ограничено числом его АО (свободных и занятых), использование которых энергетически выгодно. Для элементов первого и второго периодов энергетически выгодно использование АО только внешнего энергетического уровня. Начиная с третьего и далее периодов, кроме s- и p-орбиталей внешнего уровня, в образовании КС могут участвовать d-орбитали внешнего и (или) предвнешнего энергетических уровней. Таким образом, максимальное число КС у каждого атома ограничено его валентными возможностями, то есть связь насыщаема.
Для обеспечения наиболее полного перекрывания электронных облаков взаимодействующие атомы вынуждены располагаться в пространстве относительно друг друга определенным образом – направленно. По типу перекрывания (направленности) различают:
1. s-связь – перекрывание АО происходит вдоль оси, соединяющей ядра взаимодействующих атомов, что приводит к возникновению только одной области перекрывания. К образованию такого вида связи способны электронные облака любой формы;
2. p-связь – перекрывание АО происходит по обе стороны от оси, соединяющей ядра взаимодействующих атомов, что приводит к возникновению двух областей перекрывания. К образованию такого вида связи не способны s-электронные облака;
3. d-связь – перекрывание двух d-орбиталей, находящихся в параллельных плоскостях, с образованием четырех областей перекрывания.
Возникновение p- и d-связей происходит только в том случае, когда взаимодействующие атомы уже связаны s-связью. Наложение p- и d-связей на s-связь приводит к повышению кратности связи (уменьшению межъядерного расстояния). Например, в молекуле N2 между атомами азота связь тройная – одна s 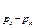 (образована перекрыванием 2px АО) и две p
(образована перекрыванием 2px АО) и две p 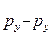 , p
, p 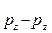 (образованы 2py и 2pz АО атомов азота). Направленность КС придает многоатомным частицам определенную форму – конфигурацию, от которой с учетом гибридизации АО зависит внутренняя структура вещества.
(образованы 2py и 2pz АО атомов азота). Направленность КС придает многоатомным частицам определенную форму – конфигурацию, от которой с учетом гибридизации АО зависит внутренняя структура вещества.
Гибридизацией АО называют процесс смешения нескольких различных по форме и энергии АО данного атома, который сопровождается образованием такого же числа новых, одинаковых по форме и энергии гибридных АО, располагающихся в пространстве относительно друг друга таким образом, чтобы обеспечить более полное перекрывание с АО соседних атомов в частице. В процессе гибридизации могут участвовать как одноэлектронные АО, так и АО, занятые спаренными электронами. Одноэлектронные гибридные АО способны образовывать связи с другими атомами и определяют тем самым геометрическую форму молекулы или иона, поэтому их называют связывающими. Двухэлектронные гибридные АО обычно не участвуют в образовании связей (исключение – донорно-акцепторный механизм), называются несвязывающими (при записи формулы молекулы их обозначают символом «Ё») и не учитываются при выявлении геометрической формы образовавшейся частицы. В табл. 3 приложения приведены наиболее распространенные виды гибридизаций АО и формы молекул, которые им соответствуют.
При образовании КС между атомами одинаковой химической природы (например, в молекулах Н2, Cl2, О2) общее электронное облако располагается в пространстве между ядрами симметрично. Такую КС называют неполярной. Если же связь образуют атомы разных элементов, то общие электроны смещаются в сторону атома с большим значением ЭО и такую КС называют полярной. Смещение электронной плотности в область более электроотрицательного элемента приводит к возникновению в его околоядерном пространстве эффективного отрицательного заряда q–, и, наоборот, недостаток электронной плотности у взаимодействующего с ним атома ведет к появлению эффективного положительного заряда q+. Такая система представляет собой электрический диполь, поэтому мерой полярности КС является величина электрического момента диполя (ЭМД) связи mА–В (Кл × м), которую можно оценить по формуле
 , (4)
, (4)
где l – длина диполя. При оценочных расчетах длину диполя можно принимать равной длине связи.
ЭМД можно также выражать в дебаях (D): 1 D = 3,33 × 10-30 Кл × м.
Полярную КС характеризуют при помощи степени ионности (СИ) и степени ковалентности (СК) связи, которые в сумме составляют 100 % (СИ + СК = 100 %). СИ показывает долю (%) смещенности общей электронной пары в область атома с большим значением ЭО. Ее можно оценить по формуле
 % , (5)
% , (5)
где е – заряд электрона (е = 1,602 × 10-19 Кл).
Из уравнения (5) следует, что с увеличением разности ЭО (DЭО) взаимодействующих атомов СИ связи увеличивается, а СК связи уменьшается. Количественная связь между СИ и DЭО приведена на рис. 1.
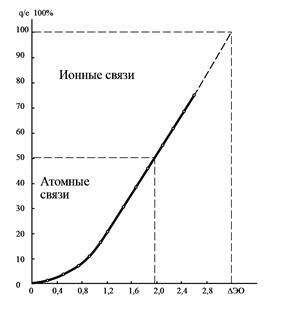
Рис. 1. Зависимость СИ от ΔЭО
mА–В – величина векторная, направленная от положительного полюса диполя к отрицательному. Например, в молекуле HF mН®F будет направлен от атома водорода к атому фтора, так как ЭО(F) > > ЭО(Н).
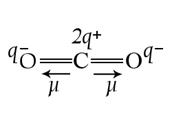
Молекулы с полярными КС в зависимости от распределения электронной плотности могут быть полярными и неполярными. Молекула считается неполярной, если ЭМД молекулыв целом m  , который определяется как геометрическая сумма ЭМД всех ее связей, равен нулю. Например, в молекуле СО2 (см. рис. 2, б), которая имеет симметричное линейное строение, ЭМД отдельных связей направлены в противоположные стороны и при их геометрическом сложении полностью компенсируют друг друга. Поэтому m
, который определяется как геометрическая сумма ЭМД всех ее связей, равен нулю. Например, в молекуле СО2 (см. рис. 2, б), которая имеет симметричное линейное строение, ЭМД отдельных связей направлены в противоположные стороны и при их геометрическом сложении полностью компенсируют друг друга. Поэтому m  = 0 и молекула СО2 является неполярной.
= 0 и молекула СО2 является неполярной.
В полярной молекуле m >0, то есть геометрическое сложение векторов ЭМД связей дает конечный вектор m
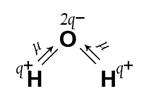
>0, то есть геометрическое сложение векторов ЭМД связей дает конечный вектор m . Так, в угловой молекуле Н2О (см. рис. 2, а) полярные связи располагаются под углом 104,5°. При геометрическом сложении ЭМД связей не происходит их взаимной компенсации, то есть m
. Так, в угловой молекуле Н2О (см. рис. 2, а) полярные связи располагаются под углом 104,5°. При геометрическом сложении ЭМД связей не происходит их взаимной компенсации, то есть m >0, молекула - полярная. В табл. 4 приложения приведены предполагаемые полярности молекул различной геометрической формы.
>0, молекула - полярная. В табл. 4 приложения приведены предполагаемые полярности молекул различной геометрической формы.
а) б)
Рис. 2. Векторное сложение ЭМД на примере молекул Н2О и СО2
Пример 1.Дипольный момент молекулы IСl равен 0,54 D. Определите степень ковалентности связи и длину диполя молекулы.
Р е ш е н и е
Из табл. 2 приложения находим ЭО атомов хлора и йода, которые равны 2,83 и 2,21 соответственно. Определяем разность ЭО атомов
DЭО(Cl – I) = 2,83 – 2,21 = 0,62.
По графику, приведенному на рис. 1, определяем СИ связи. СИ » 5 %. Тогда
СК = 100 – 5 = 95 %.
Из формулы (5) вычисляем эффективные заряды атомов
 Кл.
Кл.
В молекуле IСl присутствует только одна связь I–Cl, поэтому ЭМД молекулы и ЭДМ связи совпадают. Используя формулу (4), вычисляем длину диполя:
 .
.
Пример 2.Укажите механизм образования связей, направление смещения общих электронных пар и способ перекрывания АО в ионе SiF  . Определите тип гибридизации центрального атома, форму и полярность молекулы.
. Определите тип гибридизации центрального атома, форму и полярность молекулы.
Р е ш е н и е
Ион SiF  может быть получен при взаимодействии двух ионов F– c молекулой SiF4. Запишем электронные формулы валентных подуровней взаимодействующих атомов и ионов:
может быть получен при взаимодействии двух ионов F– c молекулой SiF4. Запишем электронные формулы валентных подуровней взаимодействующих атомов и ионов:
Si: …3s2 3p2 3d0 F: …2s2 2p5 F–: …2s2 2p6
В основном состоянии атом кремния имеет два непарных электрона на 3p подуровне, атом фтора – один непарный электрон на 2р подуровне, а ион фтора не имеет непарных электронов. Для образования четырех связей с четырьмя атомами фтора по обменному механизму атому кремния необходимо иметь четыре одноэлектронных АО, поэтому он перейдет в возбужденное состояние:
Si + E ® Si*: …3s13p3.
Свободные АО 3d-подуровня со стороны Si участвуют в образовании двух связей с ионами F– по донорно-акцепторному механизму, в которых кремний выполняет роль акцептора, а ионы фтора являются донорами. Таким образом, в частице SiF  четыре связи образованы по обменному механизму, а две – по донорно-акцепторному.
четыре связи образованы по обменному механизму, а две – по донорно-акцепторному.
Из табл. 2 приложения находим ЭО(Si) = 1,74 и ЭО(F) = 4,00. Смещение общих электронных пар происходит к более ЭО атому F.
Так как все связи в ионе SiF  являются одинарными, значит, по способу перекрывания АО они являются s-связями.
являются одинарными, значит, по способу перекрывания АО они являются s-связями.
Тип гибридизации определяем по АО кремния, которые участвовали в образовании связей независимо от механизма их возникновения. Со стороны атома Si связи образованы с участием одной s-АО, трех p-АО и двух d-АО, следовательно, тип гибридизации – sp 3 d 2, а геометрическая форма – октаэдр, так как все гибридные АО являются связывающими, то есть количество Ё = 0. По табл. 4 приложения определяем, что молекула неполярная, то есть  .
.
Дата добавления: 2018-11-26; просмотров: 609;











