ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ И ЕЕ ХАРАКТЕРИСТИКИ
Химическая связь – явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы по сравнению с энергией изолированных атомов. В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую. Кроме того, между атомами соседних молекул могут возникать взаимодействия, такие как водородная связь и вандерваальсовые силы.
Основными характеристиками химической связи являются ее энергия, длина и валентный угол.
Энергия химической связи ЕА – В (кДж/моль) – мера прочности связи, которая определяется работой, необходимой для разрушения данной связи, или энергией, которая выделяется при образовании связи из отдельных атомов. Чем больше ЕА – В, тем прочнее (устойчивее) частица. Для двухатомных простых молекул типа А2 (например, Н2 или N2) энергия связи равна энергии атомизации молекулы Еатом, т. е. энергии, которая затрачивается на распад 1 моль молекул типа А2 до атомарного состояния. Для многоатомных молекул типа АВn (например, СН4 или NH3) принято говорить о средней энергии связи  , которая может быть определена по формуле
, которая может быть определена по формуле
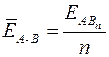 ,
,  (1)
(1)
где 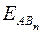 - энергия образования вещества, кДж/моль; n – число однотипных связей (обычно совпадает с числом атомов В в молекуле).
- энергия образования вещества, кДж/моль; n – число однотипных связей (обычно совпадает с числом атомов В в молекуле).
Для расчета энергии одной связи необходимо  (в кДж/моль) разделить на постоянную Авогадро NА.
(в кДж/моль) разделить на постоянную Авогадро NА.
Энергия химической связи может быть определена по положению границы между линейным и сплошным спектром молекулы. Эта граница характеризует минимальное количество энергии, необходимое для разрыва связи, то есть саму энергию связи. Энергия химической связи и длина волны света связаны между собой выражением
 , (2)
, (2)
где h – постоянная Планка; с – скорость света.
Разрыв связи в молекуле может быть осуществлен:
1) гомолитически, то есть с образованием атомов АВ ® А + В;
2) гетеролитически, то есть с образованием ионов АВ ® Аz+ + Bz-.
При изменении энергий связей в рядах однотипных соединений можно отметить следующие закономерности:
- чем больше разность между электроотрицательностями (DЭО) элементов, тем больше энергия связи между их атомами (правило Полинга);
- чем больше размеры атомов, тем меньше энергия связи;
- энергия связи в кристалле всегда больше, чем в соответствующей молекуле;
- энергия диссоциации по гомолитическому механизму ниже, чем по гетеролитическому.
Длина связи lА-В (нм) – это расстояние между ядрами химически связанных атомов. Эта характеристика зависит от размеров электронных оболочек и степени их перекрывания. Между длиной связи и ее энергией имеется определенная корреляция: чем меньше длина связи, тем больше энергия связи. Для приближенной оценки длины ковалентной связи в молекуле можно использовать формулу
 , (3)
, (3)
где 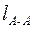 ,
, 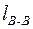 - межъядерные расстояния в молекулах А2 и В2. Половина межъядерного расстояния в простой двухатомной молекуле называется ковалентным радиусом атомаrА.
- межъядерные расстояния в молекулах А2 и В2. Половина межъядерного расстояния в простой двухатомной молекуле называется ковалентным радиусом атомаrА.
Для веществ, находящихся в кристаллическом состоянии, принято говорить о константе решетки K . Константа решетки - это расстояние между центрами двух соседних структурных частиц в кристалле. В ионном кристалле константа решетки равна сумме эффективных радиусов ионов.
Угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов, называется углом связи или валентным углом. Его определяют с учетом гибридизации центрального атома в молекуле.
Пример 1.Вычислите длину связи в молекуле Н2О, используя справочные данные о межъядерных расстояниях в молекулах Н2 и О2.
Р е ш е н и е
Из табл. 1 приложения выбираем значения длин связей в молекулах водорода и кислорода 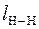 = 0,074 нм;
= 0,074 нм; 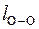 = 0,121 нм.
= 0,121 нм.
По формуле (3) вычисляем длину связи в молекуле Н2О:
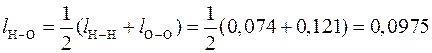 нм.
нм.
Пример 2. Константа кристаллической решетки KCl равна K = 0,316 нм. Оцените эффективный радиус иона K+, если радиус иона Cl– 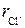 = 0,181 нм.
= 0,181 нм.
Р е ш е н и е
КСl является соединением ионного характера, поэтому эффективный радиус иона калия можно вычислить как разность между константой решетки и эффективным радиусом иона Cl–
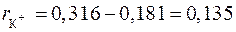 нм.
нм.
Пример 3. Средняя энергия связи N–Н в молекуле NH3 равна 385 кДж/моль. Какое количество энергии необходимо затратить, чтобы разложить на атомы: а) одну молекулу аммиака; б) 10 г аммиака?
Р е ш е н и е
Используя формулу (1), определяем энергию образования 1 моль молекул аммиака
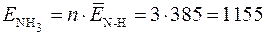
 кДж/моль.
кДж/моль.
Тогда на разрушение 1 молекулы аммиака понадобится энергия
 Дж.
Дж.
Количество энергии, необходимой для разложения 10 г аммиака, равно
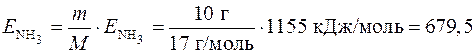
 кДж.
кДж.
Пример 4.Вычислите эффективный радиус атома хрома, если плотность данного металла равна 7,16 г/см3.
Р е ш е н и е
Дата добавления: 2018-11-26; просмотров: 603;











